
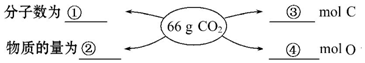
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算66个二氧化碳的分子数、物质的量及含有C、O的物质的量.
解答 解:(1)①66gCO2的物质的量为:$\frac{66g}{44g/mol}$=1.5mol,含有二氧化碳的分子数为:N(CO2)=1.5NA=1.5mol×6.02×1023mol-1=9.03×1023,
故答案为:9.03×1023(或1.5NA);
②66gCO2的物质的量为:$\frac{66g}{44g/mol}$=1.5mol,
故答案为:1.5;
③二氧化碳分子中含有1个碳原子,在1.5mol二氧化碳分子中含有C的物质的量为1.5mol,
故答案为:1.5;
④1.5mol二氧化碳分子中含有O的物质的量为:1.5mol×2=3mol,
故答案为:3.
点评 本题考查物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Se的原子序数为 24 | |
| B. | Se的氢化物的还原性比硫化氢气体强 | |
| C. | Se的非金属性比Br强 | |
| D. | Se的最高价氧化物分子式为:SeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2C=CH2$\stackrel{一定条件}{→}$
+H2C=CH2$\stackrel{一定条件}{→}$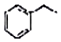
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$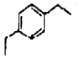
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$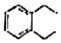
 .
.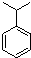 ,N:
,N: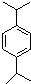 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾 KAl(SO4)2•12H2O | B. | 重晶石 BaSO4 | ||
| C. | 熟石膏 2CaSO4•H2O | D. | 绿矾 CuSO4•5H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com