
| A. | Na+、Cu2+、Cl-、NO3- | B. | Na+、K+、SO32-、CO32- | ||
| C. | K+、HCO3-、NO3-、Cl- | D. | Ca2+、Mg2+、NO3-、Cl- |
分析 在能使石蕊变红的无色溶液中存在大量氢离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.铜离子为有色离子,不满足溶液无色的条件;
B.碳酸根离子、亚硫酸根离子与氢离子反应;
C.碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
D.四种离子之间不反应,都不与氢离子反应,且为无色溶液.
解答 解:在能使石蕊变红的无色溶液为酸性溶液,溶液中存在大量氢离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Cu2+为有色离子,不满足溶液无色的要求,故A错误;
B.SO32-、CO32-与氢离子反应,在溶液中不能大量共存,故B错误;
C.HCO3-与氢离子反应,在溶液中不能大量共存,故C错误;
D.Ca2+、Mg2+、NO3-、Cl-之间不反应,都是无色离子,都不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.


科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
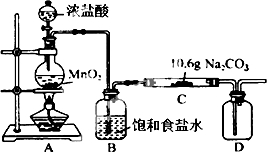 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.| 步骤 | 预期现象和结论 |
| 步骤1:取C中少量样品于试管中,滴加足量蒸馏水 至溶解,然后将所得溶液分别置于A、B试管中 | 固体物质全部完全溶解 |
| 步骤:向A试管中滴加适量BaCl溶液 | a. 如果 b. 如果 |
| 步骤: | 有白色沉淀生成,C的部分有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LH2O含有的分子数为NA | |
| B. | 1molAl3+离子含有的核外电子数为3NA | |
| C. | 3mol Fe在高温下与足量的水蒸汽反应转移的电子数为8NA | |
| D. | 1molNa2O2与足量的水反应失去电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成氯气的相对分子质量为71 | B. | 生成1 mol氯化钾转移5 NA个电子 | ||
| C. | 生成氯化钾的摩尔质量为76 g/mol | D. | 1molH37Cl参加反应转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
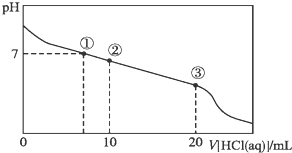
| A. | 点①所示溶液中,溶质为未反应完的CH3COONa、生成的CH3COOH和NaCl,微粒之间的关系为:c(CH3COOH)>c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中,醋酸钠有一半与盐酸反应,微粒之间的关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中,醋酸钠与盐酸恰好完全反应,微粒之间的关系为:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中有可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将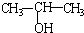 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| B. | 乙酰水杨酸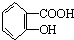 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| D. | 苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com