
 氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时化学能转化为电能 | |
| B. | 该电池的总反应为:2H2+O2═2H2O | |
| C. | 该电池中电极b是正极 | |
| D. | 外电路中电子由电极b通过导线流向电极a |
分析 A.该装置是将化学能转化为电能的装置,属于原电池;
B.该原电池反应式与氢气燃烧方程式相同;
C.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极;
D.放电时,电子从负极沿导线流向正极.
解答 解:A.该装置没有外接电源,是将化学能转化为电能的装置,属于原电池,故A正确;
B.该原电池反应式与氢气燃烧方程式相同,所以电池反应式为:2H2+O2═2H2O,故B正确;
C.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,所以通入氢气的电极a是负极、通入氧气的电极b是正极,故C正确;
D.放电时,电子从负极沿导线流向正极,a是负极、b是正极,所以电子从负极a沿导线流向正极b,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,根据得失电子判断正负极,再结合原电池概念、电子流向分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.
,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.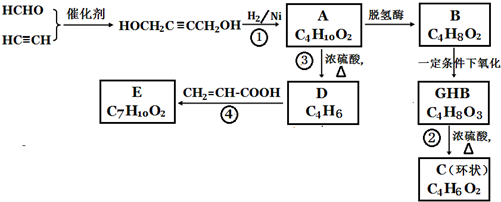
 +H2O.
+H2O.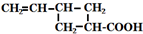 外,还有(写出结构简式)
外,还有(写出结构简式)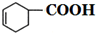 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
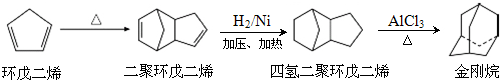
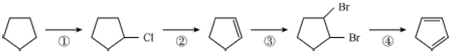
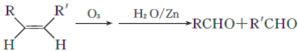
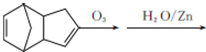
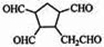 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O3 | C. | N2O | D. | N2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
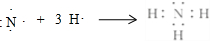
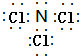
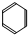 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com