
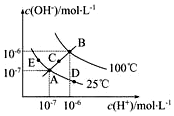
 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题:分析 (1)水的离子积常数只与温度有关,温度越高,离子积常数越大;
(2)从A点到D点c(H+)变大,c(OH-)变小,但Kw不变;
(3)E对应的温度下,Kw=10-14,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则酸溶液中的n(H+)等于碱溶液中的n(OH-),据此计算;
(4)该温度下水的离子积为Kw=1×10-12,酸和碱混合,0.05mol/L的稀硫酸溶液中氢离子浓度为1mol/L,若所得混合液的pH=2,则酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$计算,列式计算pH.可计算体积比;
(5)①溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;根据溶液呈中性pH=7c(H+)=c(OH-)结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)进行解答;
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)]进行解答.
解答 解:(1)水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E,故答案为:B>C>A=D=E;
(2)在A点时,c(H+)=c(OH-),溶液显中性,而到D点c(H+)变大,c(OH-)变小,溶液显酸性,即由A点到D点,溶液由中性变为酸性,但Kw不变.
a、升高温度,Kw变大,故a错误;
b、加入NaOH,则溶液显碱性,故b错误;
c、加入氯化铵,水解显酸性,且Kw不变,故c正确;
故答案为:c;
(3)E对应的温度下,Kw=10-14,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则酸溶液中的n(H+)等于碱溶液中的n(OH-),故有:
10-5mol/L×V碱=10-4mol/L×V酸,解得:$\frac{{V}_{碱}}{{V}_{酸}}$=$\frac{10}{1}$,
故答案为:10:1;
(4)该温度下水的离子积为Kw=1×10-12,将pH=11的苛性钠中氢氧根离子浓度为:c(OH-)=$\frac{1×1{0}^{-12}}{1×1{0}^{-11}}$mol/L=0.1mol/L,0.05mol/L的稀硫酸溶液中氢离子浓度为1mol/L,pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V2-0.1mol/L×V1=0.01mol/L×(V1+V2),
整理可得:V1:V2=9:11,
故答案为:9:11;
(5)①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.1000mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol•L-1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)=c(OH-),溶液中的溶质为乙酸钠溶液,水的电离是微弱的,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)],得到c(H+)+c(CH3COO-)+2c(CH3COOH)=c(OH-),则c(OH-)-c(H+)-c(CH3COOH)=c(CH3COO-)+c(CH3COOH),反应后溶液的体积变为60mL,则c(CH3COO-)+c(CH3COOH)═$\frac{0.1000mol/L×20ml}{60ml}$=0.033mol/L,
故答案为:0.033.
点评 本题考查酸碱混合的定性判断和溶液PH的有关计算\酸碱中和反应中的离子浓度的有关计算以及盐溶液中的三个守恒的运用,题目难度中等,注意酸碱混合时酸碱物质的量的关系以及溶液PH与c(H+)、(OH-)的关系.


科目:高中化学 来源: 题型:实验题
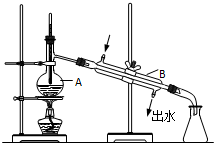 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量盐酸反应生成H2的体积为2.24 L | |
| B. | 32 g臭氧(O3)含的原子数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含的原子数目为1.5NA | |
| D. | 常温常压下,46g NO2和N2O4混合气体所含的原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂试剂 | 除去杂质的方法 |
| A | NaCl溶液 | BaCl2 | Na2CO3溶液 | 过滤 |
| B | NaCl溶液 | I2 | CCl4 | 多次萃取、分液 |
| C | CCl4 | 汽油 | H2O | 分液 |
| D | CO2 | HCl | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Z>Y>X | |
| B. | 气态氢化物:X<Z | |
| C. | X的氧化物一定是非极性分子 | |
| D. | Y单质可用于航空航天合金材料的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
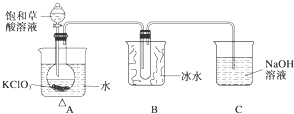 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl. | |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
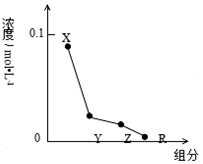
| A. | MOH的电离方程式:MOH═M++OH- | |
| B. | 该混合液中水电离出的c(H+)<l0-7mol/L | |
| C. | 该混合溶液中:c(Y)+c(X)═c(R)+c(Z) | |
| D. | 图中c(X)+c(Z)═0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加 | |
| B. | 升高温度,一般可使活化分子的百分数增大,分子间的碰撞频率提高,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com