
工业上生产下列物质,不涉及氧化还原反应的是
A.用铝矾土(主要成分Al2O3)生产金属铝
B.用硫铁矿(主要成分FeS2)生产硫酸
C.用海水、贝壳生产氯化镁晶体
D.用氯化钠生产烧碱
科目:高中化学 来源:2014-2015湖南省高一上学期期中考试化学试卷(解析版) 题型:选择题
萃取碘水中的碘,可用的萃取剂是 ①苯 ②淀粉 ③酒精
A.只有① B.①和② C.①和③ D.①②③
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
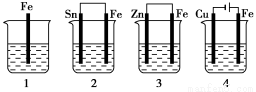
A.4>2>1>3 B.2>1>3>4
C.4>2>3>1 D.3>2>4>1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:填空题
(16分)短周期元素A、B、C、D、E的原子序数依次增大,已知:
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5︰1︰1︰3。
请回答下列问题:
(1)C的气态氢化物的电子式为 ,A在周期表中的位置 。
(2)化合物E2D2中阴、阳离子个数比为 ,F含有的化学键类型为 。
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为 。
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式 。
(5)C2A4空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30% KOH溶液。该燃料电池的负极反应式为_____ ___。
(6)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ·mol-1
2NO2(g)=N2O4(g) △H=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 _________ ___
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
常温下,电解某溶液X只生成H2和O2,下列有关电解过程的叙述正确的是(均在常温下讨论)
①X溶液浓度可能增大 ②X溶液浓度可能减小 ③X溶液浓度可能不变 ④X溶液pH可能增大 ⑤X溶液pH可能减小 ⑥X溶液pH可能不变
A.①②③④⑤⑥ B.①③④⑤⑥ C.①②④⑤⑥ D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
在某种接近中性的含Na+的无色溶液中,可能还存在NH4+、Ca2+、Br-、MnO4-、CO32-、I-、SO32-七种离子中的某几种。①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。根据上述实验事实推断,该溶液中肯定不存在的离子为
A.NH4+、Br-、CO32-、MnO4- B.NH4+、SO32-、I-、Ca2+
C.Ca2+、I-、MnO4-、SO32- D.Ca2+、CO32-、I-、SO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
选考[化学—选修5 有机化学技术] (15分)
2013年1月13日中国应用技术网报道了利用苯制备偶氮染料和医药中间体的方法,下面是制备偶氮染料F和医药中间体Y的流程图如下:
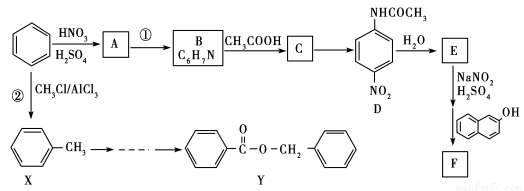
回答下列问题:
(1)苯的核磁共振氢谱中有________峰,反应①的反应类型____________;
(2)写出D→E反应的化学方程式______________________。
(3)写出化合物A、F的结构简式: A____________、F____________。
(4)设计A→D的目的是______________________。
(5)写出满足下列条件的C的任意两种同分异构体的结构简式________。
a.是苯的对位二取代产物; b.能发生银镜反应
(6)参照上述流程图设计从X到Y的合成路线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质:
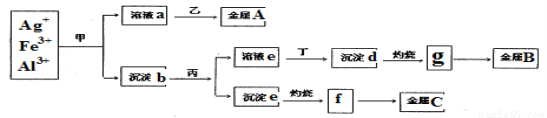
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备。对该实验分析正确的是
A.甲是氢氧化钠,丁为稀硫酸
B.沉淀b为混合物,主要成分为沉淀d和沉淀e
C.g、f都为氧化物,工业上均采用电解g与f获得对应金属单质
D.金属A、B、C分别为Ag、 Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:填空题
(12分)已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
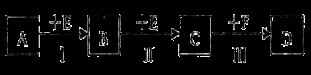
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于____________(填“离子化合物”或“共价化合物”)。
②反应I的化学方程式为____________________________________________。
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为________________mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为____________(填化学式)。
②将少景Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式__________。在该反应中若有74.5 g NaClO被还原,则转移电子的物质的量为_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com