
分析 浓硫酸具有吸水性,产物质量减轻10.8g,说明反应产物中含水10.8g,通过灼热氧化铜,由于发生反应CuO+CO$\frac{\underline{\;△\;}}{\;}$Cu+CO2,产物质量增加了3.2g,结合方程式利用差量法可计算CO的物质的量,通过碱石灰时,碱石灰的质量增加了17.6g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式,该有机物的核磁共振氢谱有三组峰,其峰面积之比为1:2:3,说明有3种H原子,且个数比为1:2:3,以此解答该题.
解答 解:(1)有机物燃烧生成水10.8g,物质的量为$\frac{10.8g}{18g/mol}$=0.6mol,
令有机物燃烧生成的CO为x,则:
CuO+CO$\frac{\underline{\;△\;}}{\;}$Cu+CO2,气态增重△m
28g 16g
x 3.2g
所以x=$\frac{28g×3.2g}{16g}$=5.6g,CO的物质的量为$\frac{5.6g}{28g/mol}$=0.2mol.
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g.
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为2mol,
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为$\frac{0.6mol×2}{0.2}$=6mol
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为$\frac{0.6mol+0.2mol+0.2mol×2-0.5mol×2}{0.2}$=1mol.
所以有机物的分子式为C2H6O.
答:有机物的分子式为C2H6O;
(2)若该有机物的核磁共振氢谱有三组峰,其峰面积之比为1:2:3,应为乙醇,结构简式为CH3CH2OH.
答:该有机物的结构简式为CH3CH2OH.
点评 本题考查了有机物分子式、结构简式的确定及有机反应方程式书写,题目难度中等,注意掌握常见有机物结构与性质,明确质量守恒定律在确定有机物分子式中的应用方法.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
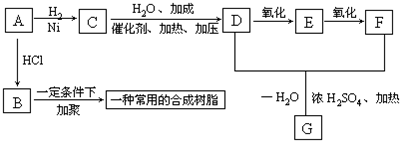
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用. | / |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤. | / |
| 步骤3:取少量步骤2得到的滤渣,加入盐酸. | |
| 步骤4: | |
| 步骤5: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 烃类分子中可能含有氧元素 | ||
| C. | 化学用语:乙酸乙脂笨 | D. | 烷烃的通式为CnH2n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
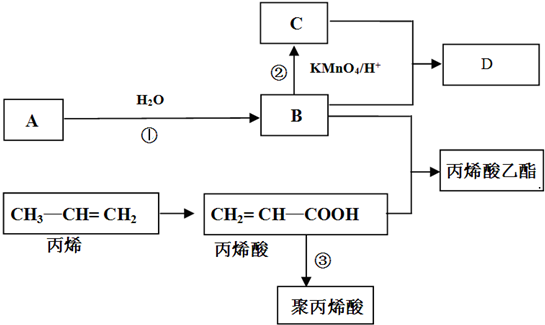
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com