
用下列装置进行实验,设计正确且能达到实验目的的是
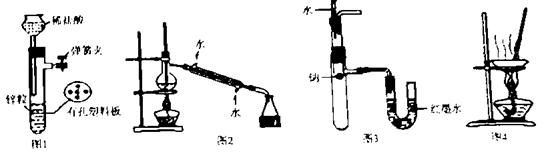
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COO C2H5的混合物
C.用图3所示装置验证Na和水反应为放热反应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
【知识点】实验设计 物质分离、气体制取 J1 J2 J3
【答案解析】C 解析:A、长颈漏斗的下端要伸到有孔的塑料隔板以下,当关闭弹簧夹的时候,稀盐酸才能重新回到漏斗使反应停止,故A错误;B、分离Na2CO3溶液和CH3COO C2H5的混合物应该用分液的方法,故B错误;C、Na和水反应如果放热就会使大试管内空气受热膨胀,引起U形管左侧液面下降,故C正确;D、NH4Cl受热易分解,不能用蒸干NH4Cl饱和溶液的方法制备NH4Cl晶体,故D错误。
故答案选C
【思路点拨】本题考查了实验设计,应该从实验目的出发先分析所采取的方法是否科学,如果方法得当,再看装置有没有不合理的地方。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列各组物质归类中与分类标准不一致的是 ( )
| 选项 | 分类标准 | 物质归类 |
| A | NO2、MnO2、Na2O2、Na2O2、Al2O3 | CO |
| B | CH3COOH、HOOC-COOH、HClO、H2S | HF |
| C | 复分解反应、电解反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)2SO4、NH4Cl、NH4NO3、(NH4)2CO3 | NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学欲分别完成“钠与氯气反应”的实验.
I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I).该方案的不足之处有 钠预先在空气中加热,会生成氧化物,影响钠在氯气中燃烧;实验过程中会产生少量污染 (至少答出两点).
II.乙同学所采用的装置如图Ⅱ,回答下列问题:
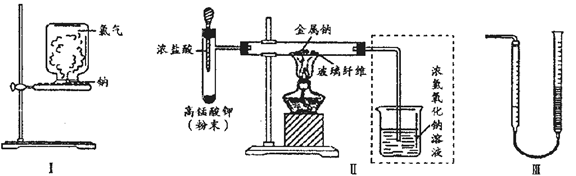
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;待装置中出现 现象后,点燃酒精灯.
(2)点燃酒精灯后,玻璃管中出现的现象是 钠熔化并燃烧,产生黄色火焰,有白烟(至少答出两点)
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积.
①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是
碱式(填“酸式”或“碱式”)滴定管.
②为提高测量的准确性,图Ⅲ装置中的液体可用 饱和NaCl溶液;收集完气体并冷却至室温后读数,读数前应进行的操作是 .
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积 (填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质.
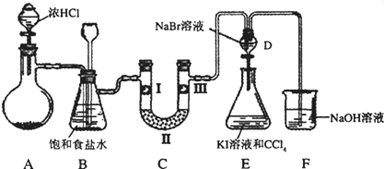
(1)若A装置中固体药品为MnO2,其化学方程式为
若A装置中固体药品为KClO3,则反应中每生成1molCl2时转移电子的物质的量为 mol.
(2)装置B的作用:
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是 .
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。但有同学认为该设计不够严密,他的理由可能 。
(5)请用化学方程式说明装置F的作用 。
(6)甲同学提出,装置F中的试剂可改用过量的Na2SO3溶液,乙同学认真思考后认为此法不可行.请用离子方程式解释乙认为不可行的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,不能达到实验目的的是 ( )
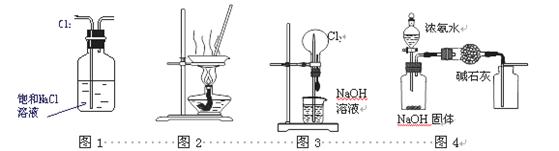
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸发KCl溶液制备无水KCl
C.用图3所示装置可以完成“喷泉”实验
D.用图4所示装置制取干燥纯净的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ(Q>0),经测定完全吸收生成的CO2需消耗 5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+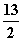
O2(g)===4CO2(g)+5H2O(g)的ΔH为( )
A.8Q kJ·mol-1 B.16Q kJ·mol-1 C.-8Q kJ·mol-1 D.-16Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O===O | P===O |
| 键能/kJ·mol-1 | 172 | 335 | 498 | X |
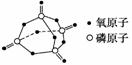
已知白磷的燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=____________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为____________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
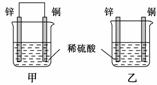
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实 现燃煤烟气中硫的回收:
现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中 进行,下列有关说法正确的是( )
进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com