


科目:高中化学 来源: 题型:
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.61×10-1 | Kb=1.77×10 |
| Kw |
| Kb |
| Kw |
| Ka2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏和石油的分馏均属于化学变化 |
| B、将碘酒滴在鸡蛋清中,可观察到鸡蛋清显蓝色 |
| C、乙酸的酯化反应和苯的硝化反应属于同种反应类型 |
| D、乙烯能够发生加成反应,结构简式为CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
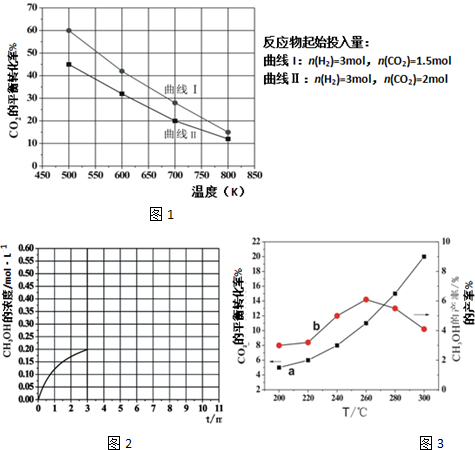
查看答案和解析>>
科目:高中化学 来源: 题型:
134 55 |
137 55 |
| A、铯元素的相对原子质量约为133 | ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com