
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
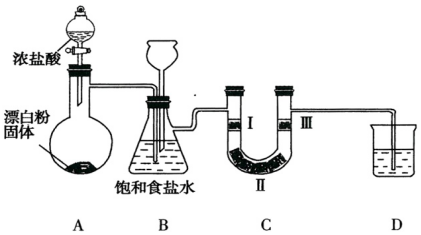
分析 (1)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大;
(2)据监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大来分析;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)据氯气有毒不能直接排放到空气中,应用碱吸收来分析;
(5)根据MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中的化学计量数之比等于参加反应的物质的量之比来计算.
解答 解:(1)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;
故答案为:除去Cl2中的HCl;
(2)监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,气体将溶液压入长颈漏斗B中,形成水柱;
故答案为:B中长颈漏斗中液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中ab的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性;c中II为固体干燥剂,不能为浓硫酸,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,故答案为:d;
(4)氯气有毒不能直接排放到空气中,故D的作用是吸收多余的氯气,防止污染空气,氯气是酸性气体,故用碱液NaOH溶液吸收,氯气与氢氧化钠反应生产氯化钠,次氯酸钠和水,反应为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:吸收多余的氯气,防止污染空气;NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O;
(5)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;
4mol 22.4L
0.4mol 2.24L
∵n(HCl)=c(HCl)V n(HCl)=0.4mol c(HCl)=10mol/L∴V=40mL,
故答案为:40.
点评 本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,是对所学知识的综合运用,注意基础知识的掌握,本题难度中等.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 20 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
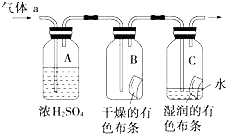 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
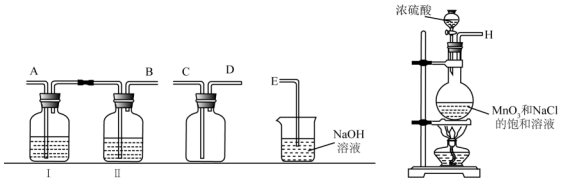
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
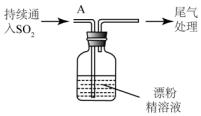 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com