
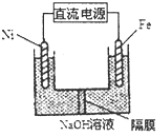
分析 (1)硬水软化的方法通常有①热煮沸法②药剂软化法③蒸馏法④离子交换法⑤电渗析法⑥离子膜电解法;用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;肥皂易与Ca2+,Mg2+生成沉淀,洗涤效果不好;
(2)电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;Na2FeO4能消毒、净水的原因高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附悬浮物的净水的作用;
(3)根据元素化合价的升降一级电子守恒来配平化学方程式;根据温度过高或过低对硝化菌均有抑制作用的知识来回答;
(4)Cr2O72-、S2O32-之间可以发生氧化还原反应,酸性环境下,氧化剂的氧化性更强,处理后的水样于试管中,加入NaOH溶液产生蓝色氢氧化铜沉淀,向该蓝色沉淀加入氨水生成[Cu(NH3)4]2+,据此书写离子方程式.
解答 解:(1)硬水软化的方法离子交换法中用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;肥皂易与Ca2+,Mg2+生成硬脂酸钙、硬脂酸镁沉淀,洗涤效果不好,洗衣粉不与Ca2+,Mg2+生成沉淀,洗涤效果较好,
故答案为:5%-8%的食盐水;肥皂的主要成分是硬脂酸钠,电离出的硬脂酸根离子易与Ca2+,Mg2+结合成沉淀,而主要成分为表面活性剂的洗衣粉可以避免这种情况;
(2)电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;Na2FeO4能消毒、净水的原因高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附悬浮物的净水的作用;
故答案为:Na2FeO4具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+水解生成Fe(OH)3胶体,能吸附水中杂质;Fe+8OH--6e-=FeO42-+4H2O;
(3)反应中,N元素的化合价升高了8价,O的化合价降低了4价,所以氧气的前边时系数2,根据电子守恒和元素守恒,得到NH4++2O2=NO3-+2H++H2O,该过程需要控制水温为20℃~36℃,因为:温度过高或过低对硝化菌均有抑制作用,甲醇与NO3-生成N3,氮元素的化合价降低了,所以甲醇中元素的化合价会升高,即甲醇做还原剂,故答案为:2;温度过高或过低对硝化菌均有抑制作用;做还原剂;
(5)Cr2O72-、S2O32-之间可以发生氧化还原反应,加入Na2S2O3溶液之前将废水调整至较强的酸性环境,是因为酸性环境下,氧化剂的氧化性更强,处理后的水样于试管中,加入NaOH溶液产生蓝色氢氧化铜沉淀,向该蓝色沉淀加入氨水生成[Cu(NH3)4]2+,发生反应的离子方程式为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O+2OH-.故答案为:酸性条件下Cr2O72-氧化性更强,有利于反应的进行;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O+2OH-.
点评 本题涉及电解池的工作原理以及氧化还原反应的概念的考查,注意知识的归纳和梳理是关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | C6H5OH+OH-→C6H5O-+H2O | |
| C. | CH3CHO+2[Ag(NH3)2]++2OH-→CH3COONH4+2Ag↓+3NH3+H2O | |
| D. | CH3CHO+2[Ag(NH3)2]++2OH-→CH3COO-+NH4++2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA | |
| B. | pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA | |
| C. | 在1L 0.1 mol•L-1CuSO4溶液中,阴离子总数大于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的溶解度减小 | |
| B. | 向2.0×10-1mol/L的K2CrO4溶液中加入等体积的2.0×10-1mol/LAgNO3溶液,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体棍合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 | |
| D. | 将0.001 mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001 mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | C | |
| B |
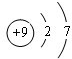 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ①和④ | C. | ②和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com