
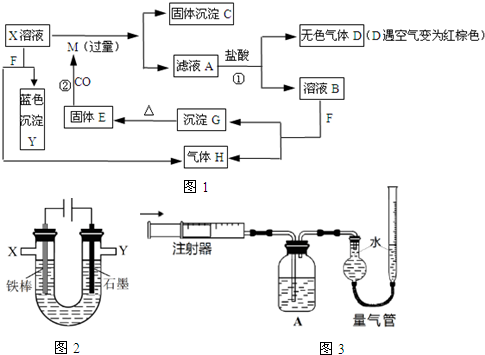
 ;G的化学式为Fe(OH)3.
;G的化学式为Fe(OH)3.分析 F为淡黄色固体,与盐X反应得到蓝色沉淀Y与气体单质H,则F为Na2O2,Y为Cu(OH)2,H为O2,X含有Cu2+.M是常见金属,与铜盐X发生置换反应,沉淀C中含有Cu及未反应的金属M,滤液A中加入盐酸生成的无色气体D遇空气变为红棕色,故D为NO,X为Cu(NO3)2,由A→D生物反应,可知M为Fe,A为Fe(NO3)2,B为铁盐,G为Fe(OH)3,E为Fe2O3;
(4)①部分C12溶解于NaCl溶液中,溶解的氯气可以氧化碘离子为碘单质,碘遇淀粉变蓝色,据此设计;
②Y为阳极,收集到的V2mL气体中主要是氯气,所以证明有O2生成首先要除去氯气,当量气管的右侧液面上升,则说明含有氧气生成;
③空气对压强不影响,所以实验中不需要预先除净装置中的空气;
④阴极X处收集到的氢气为V1mL,阳极Y处收集到为氯气和氧气,最终量气管中收集到V3mL气体为氧气,设在石墨电极上生成Cl2的总体积为xml,则根据电解阴阳两极的得失电子守恒计算.
解答 解:F为淡黄色固体,与盐X反应得到蓝色沉淀Y与气体单质H,则F为Na2O2,Y为Cu(OH)2,H为O2,X含有Cu2+.M是常见金属,与铜盐X发生置换反应,沉淀C中含有Cu及未反应的金属M,滤液A中加入盐酸生成的无色气体D遇空气变为红棕色,故D为NO,X为Cu(NO3)2,由A→D生物反应,可知M为Fe,A为Fe(NO3)2,B为铁盐,G为Fe(OH)3,E为Fe2O3.
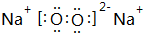
(1)F为Na2O2,电子式为 ;G的化学式为Fe(OH)3,
;G的化学式为Fe(OH)3,
故答案为: ;Fe(OH)3;
;Fe(OH)3;
(2)反应①的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(3)设Fe2+的物质的量为xmol,则:
Cu2++Fe═Fe2++Cu 质量增重
1mol 64g-56g=8g
xmol 9.32g-9g=0.32g
故1mol:xmol=8g:0.32g,解得x=0.04,则滤液A中溶质的物质的量浓度为$\frac{0.04mol}{0.1L}$=0.4mol/L,
故答案为:0.4mol/L;
(4)①因为氯气可使湿润的淀粉KI试纸变蓝,证明有部分C12溶解于NaCl溶液中,可取少量石墨电极附近溶液,滴在淀粉KI试纸上,试纸变蓝,说明含有氯气,
故答案为:取少量石墨电极附近溶液,滴在淀粉KI试纸上,试纸变蓝;
②Y为阳极,收集到的V2mL气体中主要是氯气,所以证明有O2生成首先要除去氯气,当量气管的右侧液面上升,则说明含有氧气生成,则装置A的作用是完全吸收氯气,故答案为:完全吸收氯气;
故答案为:完全吸收氯气;
③空气对压强不影响,所以实验中不需要预先除净装置中的空气,
故答案为:否;
④阴极X处收集到的氢气为V1mL,阳极Y处收集到为氯气和氧气,最终量气管中收集到V3mL气体为氧气,设在石墨电极上生成Cl2的总体积为xml,则根据电解阴阳两极的得失电子守恒,V1×2=x×2+V3×4,所以x=V1-2V3,故答案为:(V1-2V3).
点评 本题考查无机物推断、探究实验,属于拼合型题目,题目综合性较强,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)  cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
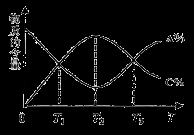
A.该反应在T1、T3温度时达到过化学平衡 B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应 D.升高温度,平衡会向正反应 方向移动
方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学反应中物质变化的实质是旧化学键断裂和新化学键形成 | |
| B. | 燃烧可看成“储存”在物质内部的能量转化为热能、光能等释放出来 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 甲烷与氯气在光照条件下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能使pH试纸变红色的溶液中:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
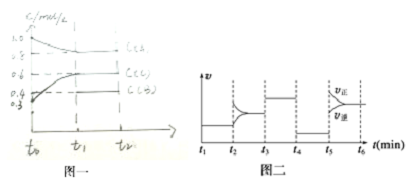
| A. | t4-t5阶段改变的条件为减小压强 | |
| B. | B的起始物质的量为1.0 mol | |
| C. | 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡(与t1时刻浓度相同),a、b、c要满足的条件为a+$\frac{2c}{3}$=2.4和b+$\frac{c}{3}$=1.2 | |
| D. | 此温度下该反应的化学方程式为2A(g)+B(g)?2C(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com