
| |||||||||||||||
科目:高中化学 来源: 题型:阅读理解
 (2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:038
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:填空题
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3,
反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3,
反应过程中测定的部分数据见下表
|
反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
|
0 |
1.20 |
1.60 |
|
2 |
0.90 |
|
|
4 |
|
0.40 |
(1)反应在2min内的平均速率为v(NH3)=
4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2) 700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系密度保持不变 d.每消耗1 mol NO2的同时生成2 mol H2O
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)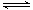 CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将
移动(填向左,向右,不);CO的浓度将
(增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将
移动(填向左,向右,不);CO的浓度将
(增大,减小,不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com