
四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2.实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中;再向反应器中缓慢地通入干燥的氯气。
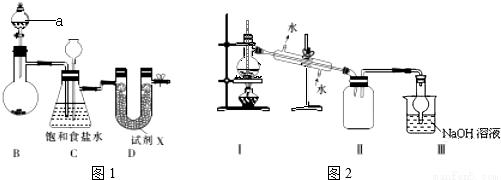
Ⅰ.图1示实验室制备干燥氯气的实验装置(夹持装置己略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,A中发生反应的化学方程式为_____________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有_____________作用。
(3)试剂X可能为_____________(填写字母).
A.无水氯化钙 B.浓硫酸 C.碱石灰 D.五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式_____________。
(5)用锡花代替锡粒的目的是_____________。
II.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是_____________、_____________。
(7)实验用的锡花中含有金属铜。甲同学设计下列实验测定锡花的纯度。
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用1.000mol/LK2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为(未配平):
Fe2++Cr2O72-+H+→Cr3++Fe3++H2O
若达到滴定终点时共消耗20.00mlK2Cr2O7溶液,试计算锡花中锡的百分含量_____________(结果保留三位有效数字)。
科目:高中化学 来源:2015-2016学年云南省高一下期中化学试卷(解析版) 题型:选择题
可逆反应2A(g)+3B(g) 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)=0.5mol•-1 ②v(B)=0.6mol•-1
③v(C)=0.35mol•-1 ④v(D)=0.4mol•-1
该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s) CaO(s)+CO2(g), 达到平衡,下列说法正确的是
CaO(s)+CO2(g), 达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.将体积增大为原来的2倍,再次达到平衡时,气体的密度变小
C.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
D.保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,错误的是

A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③检查乙炔的还原性
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
下列实验现象可用同一原理解释的是
A.溴水分别滴入植物油和裂化汽油中,溴水均褪色
B.品红溶液中分别通入SO2和Cl2,品红均褪色
C.鸡蛋白溶液中分别加入NaCl溶液和HgC12溶液,均有固体析出
D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:选择题
有机物Q的分子式为C5H10O3,一定条件下Q遇NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为1:1,则Q的结构最多有( )
A.12种 B.10种 C.8种 D.7种
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:填空题
氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2
 N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
25 ℃时,水电离出的H+浓度是5×10-13 mol·L-1的硫酸溶液中,硫酸溶液的浓度为 ( )
A.0.01mol·L-1 B.0. 02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考前训练二理综化学试卷(解析版) 题型:选择题
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼( N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述正确的是( )

A.电子从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4 - 4e-=N2+4H+
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时.K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com