
| A. | Cu与过量浓HNO3反应,生成的气体呈红棕色 | |
| B. | 足量H2通过灼热的CuO粉末后,生成的固体为红色 | |
| C. | AgNO3溶液与足量Na2S溶液反应后再滴加NaCl溶液,沉淀为白色 | |
| D. | 物质的量相同的CH3COOH与NaOH反应后滴加酚酞,溶液显红色 |
分析 A.铜和浓硝酸反应生成红棕色气体二氧化氮;
B.氢气具有还原性,能还原黑色的CuO生成红色的Cu;
C.硫化钠和硝酸银反应生成黑色的硫化银沉淀,硫化银不能转化为AgCl白色沉淀;
D.物质的量相同的醋酸和NaOH恰好完全反应生成醋酸钠,醋酸钠溶液呈碱性而使酚酞试液变红色.
解答 解:A.浓硝酸具有强氧化性,铜和浓硝酸反应生成红棕色气体二氧化氮,所以生成的气体呈红棕色,故A正确;
B.氢气具有还原性,能还原黑色的CuO生成红色的Cu,看到的现象是:固体由黑色变为红色,故B正确;
C.硫化银溶解度小于氯化银,硫化钠和硝酸银反应生成黑色的硫化银沉淀,所以硫化银不能转化为AgCl白色沉淀,故C错误;
D.物质的量相同的醋酸和NaOH恰好完全反应生成醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解而导致溶液呈碱性,所以醋酸钠溶液使酚酞试液变红色,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,涉及物质性质、难溶物转化、盐类水解等知识点,侧重考查学生分析判断及实验操作能力,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
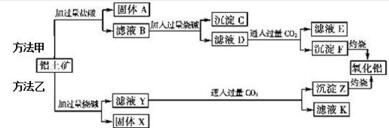
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g冰晶体中含有氢键的数目为2NA | |
| B. | 1molH2O2中含有非极性键的数目为NA | |
| C. | 1molSiO2晶体中含有Si-O键的数目为4NA | |
| D. | 22.4LHF(标准状况)中含有氟原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量,则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
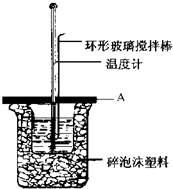 如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).
如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
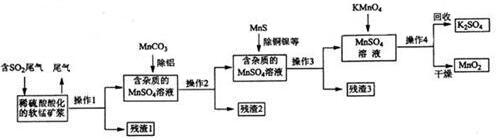
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的负极锌发生还原反应 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.lmol Zn完全溶解时,流经电解液的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为 MnO2+e-+H20═MnO(OH)+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
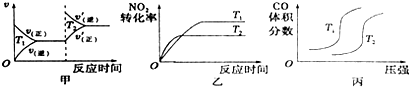
| 浓度/mol.L-1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯 | |
| C. | 苯中含有杂质苯酚,可用浓溴水来除杂 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com