
【题目】下列化合物中氯元素的化合价为+5价的是
A. HCl B. NaClO C. KClO3 D. HClO4
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是
A.为了防止食品受潮变质,常在食品包装袋中放入生石灰
B.不可用铝制餐具长时间存放酸性或碱性食物
C.明矾可用于净水
D.为防止铁制品生锈,可以在铁制品的外层涂油漆或局部镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
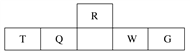
A. 离子半径:T<W<G
B. 等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C. 最简单气态氢化物的热稳定性:Q<R
D. T和G组成的化合物溶于水,其水溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列各组物质:
①O2和O3 ②CH2=CH﹣CH3和CH2=CH﹣CH=CH2 ③ 和
和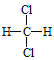
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3
⑤CH3CH2CH3和CH3C(CH3)3
⑥![]() 和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
按要求用序号填空
属于同系物的是________ 属于同分异构体的是_____属于同种物质的是________
(2)下列反应中,属于吸热反应的是__________.
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应.
(3)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(4)已知:2H2(g)+O2(g)=2H2O(g) △H=-483 kJ·mol -1N2(g)+2O2(g)=2NO2(g) △H=+68kJ·mol -1则H2还原NO2生成水蒸气的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________。
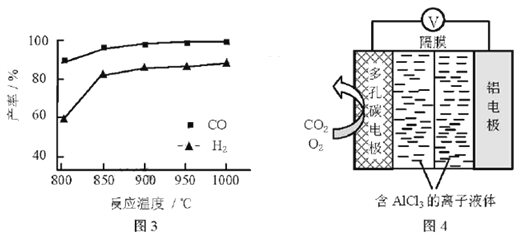
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e![]() 6O2
6O2
6CO2+6O2![]() 3C2O42
3C2O42
反应过程中O2的作用是________。
该电池的总反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、M、N六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子,其中B的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,M的L层电子数为K层和M层电子数之和,D和M同主族。回答下列问题:
(1)元素B的符号和名称分别是______,_____;在周期表中的位置是____________。
(2)元素C的原子结构示意图为______________________________。
(3)元素C与M可形成CM2,C与N可形成CN4,这两种化合物均可做溶剂,其电子式分别为:_________和_________。
(4)元素A与D、E形成10电子分子的结构式分别为:__________和__________。
(5)元素C和M相比,非金属性较强的是_________(用元素符号表示)。
(6)元素D、M的氢化物的沸点高低顺序为:_________(用化学式表示)。
(7)在一定条件下,A、D的单质和M的最高价氧化物对应水化物的溶液可构成原电池,该电池在放电过程中,电解质溶液的酸性将_________(填“增大”“减小”或“不变”)。
(8)1 mol CA4与D2完全反应生成两种气体时放出热量802kJ,则该反应的热化学方程式为__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米科技从本世纪初开始成为产业,为世人所瞩目,这是因为纳米粒子的直径在1纳米到100纳米之间,由纳米材料作为分散质的分散系具有的性质是( )
A.能通过滤纸,属最稳定的分散系B.属于介稳体系
C.有丁达尔效应,没有布朗运动D.一定能发生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下

已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1mol/L形成氢氧化物沉淀的pH范围如下:
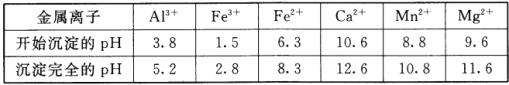
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为__________________。
分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为_________、氯化铵与锰矿粉的质量之比为_________、焙烧时间为_________。

(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中c(Ca2+)/c(Mg2+)=_________。
(3)碳化结晶时,反应的离子方程式为__________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学教材中元素周期表的一部分,其中标出A~R15种元素,试根据它们回答下列问题(填具体元素符号或化学式):
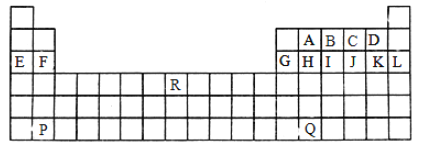
(1)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是_____,第三周期元素形成的简单离子中半径最小的是______。
(2)C与E可形成一种具有漂白性的物质,它含有的化学键为_____。
(3)Q在元素周期表中的位置是____,B、C可形成化合物B2C,该化合物的核外电子总数为____。
(4)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:_____。
(5)元素E与元素F相比,金属性较强的是____(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com