
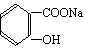 | |||
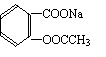 | |||
将 转变为 的方法为
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
NaHCO3溶液与Ca(OH)2溶液反应
(1)NaHCO3少量__________________________________________________________;
(2)NaHCO3足量__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是 ( )
A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O===2Fe(OH)2
B.SO2使紫色石蕊溶液变红色:SO2+H2O===2H++SO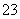
C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-+3H2O===2[Al(OH)4]-
D.84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+===Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物说法正确的是
A.75%(体积分数)的乙醇溶液常用于医疗消毒 B. 乙醇、乙烷和乙酸都可以与钠反应生成氢气
C.苯和乙烯都可以使溴的四氯化碳溶液褪色 D.石油分馏可获得乙酸、苯及其衍生物
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq) Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是
。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b .饱和Na2SO3溶液
c.饱和NaHSO3溶液 d . 饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有 。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
。
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D. AgCl是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com