
【题目】镁—次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。下列有关说法正确的是( )
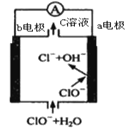
A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,c溶液中的溶质是MgCl2
C.负极反应式:ClO-+2e-+H2O=Cl-+2OH-
D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.2molCl-
【答案】A
【解析】
根据电池的装置示意图和电池反应分析可知,ClO-→Cl-,化合价降低,得电子,根据原电池的工作原理,a极为正极,b极为负极,正极反应式为ClO-+H2O+2e-=Cl-+2OH-,负极反应式为Mg+2OH--2e-=Mg(OH)2,据此分析解答。
A.根据上述分析可知,正极a为正极,电极反应式为ClO-+H2O+2e-=Cl-+2OH-,因此正极a附近的pH将不断增大,A选项正确;
B.根据分析可知,Mg失电子生成Mg(OH)2,则c溶液中的溶质不是MgCl2,B选项错误;
C.b极为负极,电极反应式为Mg+2OH--2e-=Mg(OH)2,C选项错误;
D.根据a电极的电极反应式ClO-+H2O+2e-=Cl-+2OH-可知,每转移0.2mol电子,理论上生成0.1molCl-,D选项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R 是周期表中前 36 号元素,核电荷数依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 为非金属元素,且 X 原子的核外成对电子数是未成对电子数的 2 倍,Z 的次外层电子数是最外层电子数的![]() ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
(1)X的最高价氧化物对应的水化物分子中,中心原子采取______________杂化。
(2)化合物 XZ 与 Y 的单质分子互为______________,1mol XZ 中含有π键的数目为______________。
(3)W 的稳定离子核外有______________种运动状态的电子。W元素的第一电离能比其同周期 相邻元素的第一电离能高,其原因是:_____。
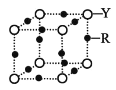
(4)Q 的晶体结构如图所示,则在单位晶胞中 Q 原子的个数为______________,晶体的配位数是______________。

(5)R元素的基态原子的核外电子排布式为________;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为 NA,则该晶体中 R 原子和 Y 原子之间的最短距离为______________cm。(只写计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。回答以下问题:
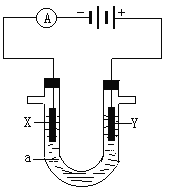
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,在 X极附近观察到的现象是:________________。
(2)Y电极上的电极反应式是_________,检验该电极反应产物的方法是:______________。
(3)如果用电解方法精炼粗铜(粗铜中含有杂质锌和银),电解液a选用CuSO4溶液,则Y 电极的材料是____,电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用SO2和Cl2在活性炭作用下制取SO2C12,原理为SO2(g)+Cl2(g)SO2Cl2(l) H=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2C12的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是

A.乙中盛放的试剂为无水氯化钙
B.制备过程中需要将装置甲置于冰水浴中
C.用来冷却的水应该从a口入,b口出
D.可用硝酸与亚硫酸钠反应制备二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
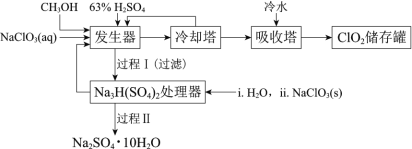
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH=12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2Ob.相关物质的熔沸点:
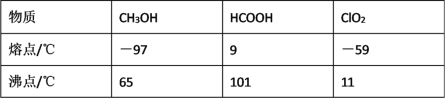
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有_____性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为 ______________(填字母)。
a.0~10℃ b.20~30℃ c.60~70℃
(3)可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如图:

① Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因 __(结合方程回答)。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,_______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和_____。
(4)为测定存储罐中所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇 匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
①准确量取10.00 mL ClO2溶液的玻璃仪器是______。
②若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_____ (填“偏高”、“偏低”或“无影响”)
③根据上述步骤可计算出原ClO2溶液的浓度为_____mol·L-1(用含字母的代数式表示)。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_______。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性 与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的价电子排布式为_______;上述材料中所含元素的基态原子中,未成对电子数最多的是_______ (填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)x]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是______(填元素符号);[Fe(CN)6] 4-中含有σ键与π键的数目比为_____________。
(3)K3AsO3可用于碘的微量分析。
①AsO33-的立体构型为_______,写出一种与其互为等电子体的分子_______(填化学式)。
②K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为_______。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为_______。

a.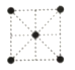 b.
b. c.
c. d.
d.
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
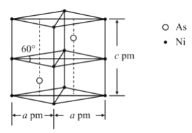
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识,分析并回答下列各小题。
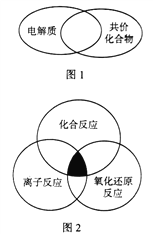
(1)下列物质属于图1所示化学概念交叉部分的有______(填标号)。
a.氨气 b.硝酸 c.乙醇 d.醋酸钠
(2)下列各反应属于图2中阴影部分所示关系的有_______(填标号)。
a.氨气与浓硝酸
b.氢气与氧气
c.氯气与氯化亚铁溶液
d.铜与氯化铁溶液
(3)下列有关说法正确的是_____(填标号)。
a.核电站把核能转化为电能
b.常温下铜与浓硫酸发生钝化。反应很快停止
c.海水中提取化学物质均涉及到氧化还原反应
d.电解法得到某元素单质,则该元素可能被还原,也可能被氧化
(4)下列各实验过程中,需要检查所用某些仪器是否漏水的有_______(填标号)。
a.氢气还原氧化铜
b.水与煤油混合物分离
c.氯化钠溶液与泥沙分离
d.配制100mL 10mol·L-1碳酸钠溶液
(5)下列关于试剂保存的叙述正确的是_________(填标号)。
a.氢氟酸保存在玻璃瓶中
b.KOH溶液保存在带玻璃塞的细口瓶中
c.溴水保存在带橡胶塞的棕色瓶中
d.KMnO4与乙醇不能放在同一药品厨中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电能是现代社会应用最广泛的能源之一。
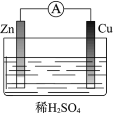
(1)某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”)反应。电子由______极流出(Zn或Cu),电解质溶液中SO![]() 移向______(Zn或Cu)。
移向______(Zn或Cu)。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com