
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
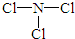 ;
;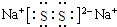 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .分析 Ⅰ、有X、Y、Z、R四种短周期元素,Y、Z、R同周期,
X单质为双原子分子,若低温蒸发液态空气,因其沸点较低可先获得X的单质氮气,则X为N元素;
含有Y元素的物质焰色反应为黄色,则Y为Na元素;
Z是其同周期元素中原子半径最小的,且与Y同一周期,则Z为Cl元素;
R元素原子的最外层电子数是K层电子数的3倍,且与Y、Z同一周期,则R为S元素;
(1)Z为Cl元素,主族元素原子核外电子层数与其周期数相同,最外层电子数与其族序数相同,据此判断Z元素在周期表的位置,Y、Z、R元素分别是Na、Cl、S,电子层结构相同的离子半径随着原子序数增大而减小,离子中电子层数越多其离子半径越大;
(2)由N、Cl两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构,则甲为NCl3,甲遇水蒸气可形成一种常见的漂白性物质,为HClO;
(3)化合物乙(Na2S)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Na2S2,其溶液显黄色,根据过氧化钠电子式书写Y2R2的电子式,根据反应物和生成物书写方程式;
Ⅱ、元素N与氢可形成多种化合物,如丙、丁、戊.
X为N元素,元素X与氢可形成多种化合物,如丙、丁、戊,丙与醋酸类似,为一元弱酸,设丙的分子式为HNm,HNm分解的方程式为2HNm=H2+mN2,8.6gHNm爆炸分解生成H2和6.72L(标况下)N2,氮气为$\frac{6.72L}{22.4L/mol}$=0.3mol,则2:m=$\frac{8.6}{1+14m}$:0.3,解得m=3,所以丙为HN3,丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则戊的相对分子质量为0.76×22.4=17,所以戊为氨气,则丁为NH4H.
解答 解:Ⅰ、有X、Y、Z、R四种短周期元素,Y、Z、R同周期,
X单质为双原子分子,若低温蒸发液态空气,因其沸点较低可先获得X的单质氮气,则X为N元素;
含有Y元素的物质焰色反应为黄色,则Y为Na元素;
Z是其同周期元素中原子半径最小的,且与Y同一周期,则Z为Cl元素;
R元素原子的最外层电子数是K层电子数的3倍,且与Y、Z同一周期,则R为S元素;
(1)Z为Cl元素,主族元素原子核外电子层数与其周期数相同,最外层电子数与其族序数相同,Z元素原子核外有3个电子层、最外层有7个电子,所以位于第三周期第VIIA族,Y、Z、R元素分别是Na、Cl、S,电子层结构相同的离子半径随着原子序数增大而减小,离子中电子层数越多其离子半径越大,所以离子半径大小顺序是S2->Cl->Na+,故答案为:第三周期第VIIA族;S2->Cl->Na+;
(2)由N、Cl两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构,则甲为NCl3,甲遇水蒸气可形成一种常见的漂白性物质,为HClO,则甲结构式为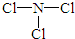 ,故答案为:
,故答案为: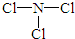 ;
;
(3)化合物乙(Na2S)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Na2S2,其溶液显黄色,根据过氧化钠电子式书写Y2R2的电子式为,根据反应物和生成物书写方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,
故答案为: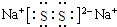 ;4Na2S+O2+2H2O═4NaOH+2Na2S2;
;4Na2S+O2+2H2O═4NaOH+2Na2S2;
Ⅱ、元素N与氢可形成多种化合物,如丙、丁、戊.
X为N元素,元素X与氢可形成多种化合物,如丙、丁、戊,丙与醋酸类似,为一元弱酸,设丙的分子式为HNm,HNm分解的方程式为2HNm=H2+mN2,8.6gHNm爆炸分解生成H2和6.72L(标况下)N2,氮气为$\frac{6.72L}{22.4L/mol}$=0.3mol,则2:m=$\frac{8.6}{1+14m}$:0.3,解得m=3,所以丙为HN3,丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则戊的相对分子质量为0.76×22.4=17,所以戊为氨气,则丁为NH4H,
(4)丙为HN3,反应方程式为:2HN3=3N2+H2 ,
故答案为:2HN3=3N2+H2 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则戊的相对分子质量为0.76×22.4=17,所以戊为氨气,则丁为NH4H,
故答案为:NH4H;
(6)氨气在高温条件下能还原Fe2O3,生成氮气和铁,反应方程式为2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O;有人提出生成的产物中可能还有FeO,其检验方法为取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无,
故答案为:2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O;取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
点评 本题考查元素化合物推断,推断元素是解题关键,侧重考查学生知识迁移应用与分析推理能力,习题中所涉及物质在中学中没有,需要学生通过题给信息进行分析推断,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当分子式中的x≤4时,上述烃在常温常压下均为气体 | |
| B. | 分子式中的y一定为偶数 | |
| C. | 1mol的上述烃完全燃烧时,耗氧($\frac{x+y}{4}$)mol | |
| D. | 150℃时,在密闭的容器中完全燃烧后,测得的压强一定比燃烧前增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA | |
| C. | 常温常压下,28 g CO和N2的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,22.4 L H2S和SO2的混合气体中含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴的四氯化碳褪色 | |
| B. | 石油分馏是物理变化,可得到汽油、煤油等物质 | |
| C. | 石油裂化主要得到乙烯 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
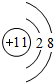 ,C的原子结构示意图为
,C的原子结构示意图为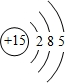 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量等于NA个氯化氢分子的质量 | |
| B. | 常温常压下1mol二氧化碳的体积大于22.4L | |
| C. | 64g金属铜发生氧化反应,一定失去2NA个电子 | |
| D. | 62g氧化钠溶于水后,所得溶液中含有NA个O2-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
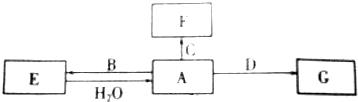
 ,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com