
【题目】(1)H2O的相对分子质量是______;1 molH2O质量是______克;1.5 mol H2O的质量为_____;H2O的摩尔质量是_____。
(2)3.01×1022个OH-的物质的量为____mol,质量为___。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.将1mol氯化铁完全溶于水制成胶体,其中所含胶体粒子数目小于NA
B.标准状况下22.4 L HF中含有的氟原子数目为NA
C.常温下,2.8g C2H4与C3H6的混合物中共价键数为0.6NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备、收集干燥的![]() ,所需仪器如图:
,所需仪器如图:
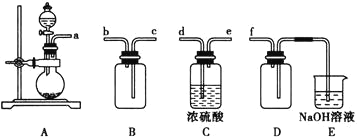
(1)写出实验室制取SO2的化学方程式__________
(2)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→_____→____→_____→____→f。
(3)装置D的作用是______,装置E中NaOH溶液的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
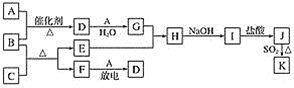
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图Ⅰ~Ⅳ所示,下列有关说法正确的是( )
A.实验Ⅰ可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体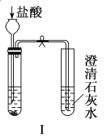
B.实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠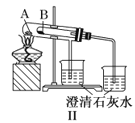
C.与实验Ⅲ相比,实验Ⅱ的优点是可以用一套装置同时进行两个对比实验,而Ⅲ不行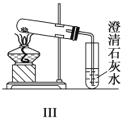
D.实验Ⅳ分别测定等浓度碳酸钠和碳酸氢钠溶液的pH,碳酸氢钠溶液pH大于碳酸钠溶液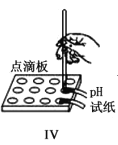
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制250mL0.1molL-1的稀盐酸,实验室的浓盐酸密度为1.25gcm-3,质量分数为36.5%。
请回答下列问题:
(1)配制稀盐酸时下表中不需要使用的仪器有___(填序号),还缺少的仪器为___、___(写仪器名称)。
序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
仪器 |
|
|
|
|
|
|
(2)需要量取浓盐酸的体积为___mL。
(3)配制该溶液的操作顺序是:D→___→___→___→___→B(用字母符号表示,每个字母符号只用一次)。
A.用30mL蒸馏水洗涤烧杯和玻璃棒各2~3次,将洗涤液全部注入容量瓶中并轻轻摇动
B.将容量瓶盖紧,振满,摇匀
C.将已恢复至室温的盐酸沿玻璃棒注入所选用的容量瓶中
D.用量筒准确量取所需体积的浓盐酸,将其沿玻璃棒注入烧杯中,再向烧杯中加入少量蒸馏水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶的刻度线相切
F.继续往容量瓶中小心地滴加蒸馏水,直到液面接近刻度线1~2cm处
(4)在定容时,液面高于刻度线,则所配溶液的浓度将___(选填“偏高”或“偏低”),该如何处理?___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CH3OH的摩尔质量是__gmol-1。
(2)2molH2O中所含原子的物质的量为__mol。
(3)__g的氢气中所含H原子的数目与1molCH3OH相同。
(4)含0.1NA个O的CO2中有__个电子,标况下该CO2的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中 Br2 的物质的量和反应后溶液中 Br—离子的物质的量。
(1)方案一是否可行__________填(“是”或“否”),理由是____________________。
(2)假设测得反应前溴水中 Br2 的物质的量为 amol,
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生取代反应;
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生加成反应;
若测得反应后 n(Br-)=__________mol,则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比为 1︰5 配制 1000mLKBrO3-KBr 溶液,该溶液在酸性条件下完全反应可生成 0.5molBr2。取该溶液 10mL 加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为 100mL,准确量取其中 10mL,加入过量的 AgNO3 溶液,过滤、洗涤、干燥后称量得到固体 0.188g。若已知 CH3COOAg 易溶于水,试通过计算判断溴水与乙醛发生反应的类型为__________(选填猜想序号)。
(4)写出上述测定过程中的三个反应的离子方程式:
①KBrO3 和KBr 在酸性条件下的反应:______________________________;
②溴水与乙醛的反应:______________________________;
③测定 Br-离子含量的反应:______________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com