
| A、Cu(OH)2中加入硫酸:OH-+H+=H2O |
| B、钠加入水中:Na+2H2O=Na++2OH-+H2↑ |
| C、向Ca(HCO3)2溶液加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| D、A12(SO4)3溶液中加入过量Ba(OH2)溶液:2A13++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓ |


科目:高中化学 来源: 题型:
| A、CO能使人中毒的原理是CO能将人体血液中的Fe2+氧化 |
| B、采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,提高空气质量 |
| C、推广可利用太阳能、风能等新能源,发展低碳经济,同时能大大减少对环境的污染 |
| D、PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验操作 | 预期现象和结论 |
| 步骤一;取硬质玻璃管中固体产物少量分别与A、B试管中,加入足量1mol/L CuSO4溶液,搅拌溶解. |
(1)若A试管中黑色固体不溶解,并且没有观察到其它现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有 |
| 步骤二:对试管B中溶液过滤,将所的固体洗涤干净后加足量1mol/L盐酸后再依次分别加入适量0.01mol/L氨水、少量0.01mol/L KSCN溶液. | ①若溶液不变红色,则 ②若溶液变红色,则 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 族元素;E和C位于同一主族,F的原子序数为24.
族元素;E和C位于同一主族,F的原子序数为24.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铜片上有红色物质附着 |
| B、取出盐桥后,电流计依然发生偏转 |
| C、反应中,盐桥中的K+会移向CuSO4溶液 |
| D、锌片上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、Cl-、HCO3- |
| B、K+、Al3+、Cl-、S2- |
| C、Na+、Ca2+、HCO3-、OH- |
| D、Fe3+、H+、ClO-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=2的H2SO4溶液中含有的H+离子数目为0.01NA |
| B、当H2O与Na2O2反应生成1 molO2时,转移的电子数目为4NA |
| C、标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数为0.1NA |
| D、1 L 0.1 mol?L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、图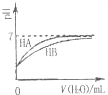 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液pH小于同浓度的NaB溶液的pH |
B、图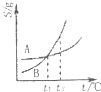 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至 t2℃时,溶质的质量分数B>A |
C、图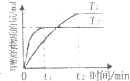 表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合甲醇是吸热反应 |
D、图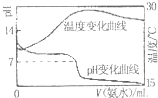 表示将1.00mo1?L-1氨水滴入20.00mL 1.000 mo1?L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com