
分析 (1)由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,以此解答;
(2)电子从负极流出,电解质溶液中阴离子移向负极;
(3)负极铁失电子发生氧化反应,三价铁离子在正极得电子发生还原反应;
(4)根据电子转移守恒计算负极反应的物质的量,再计算质量.
解答 解:(1)由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,电解质溶液用氯化亚铁,正极为活泼性比铁弱的金属或非金属,比如C棒,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,则装置图为: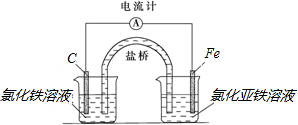 ,
,
故答案为: ;
;
(2)电子从负极铁流出,电解质溶液中阴离子移向负极,
故答案为:铁;铁;
(3)负极为Fe发生氧化反应生成Fe2+,电极反应式为Fe-2e-=Fe2+,正极发生还原反应,Fe3+被还原生成Fe2+,电极方程式为2Fe3++2e-=2Fe2+,
故答案为:Fe-2e-=Fe2+;2Fe3++2e-=2Fe2+;
(4)电极反应式为Fe-2e-=Fe2+,当线路中有0.2mol电子发生转移时,铁溶解0.1mol,则负极减轻的质量为:0.1mol×56g/mol=5.6g,
故答案为:5.6.
点评 本题考查了原电池设计,根据方程式知元素化合价变化确定负极、电解质溶液,注意装置图是学生的弱点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 加热时,②、③中的溶液为无色,冷却后又都变红 | |
| C. | ④中,浸泡在热水中的容器内气体颜色变浅,浸泡在冰水中的容器内气体颜色变深 | |
| D. | 四个“封管实验”中不是都有可逆反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
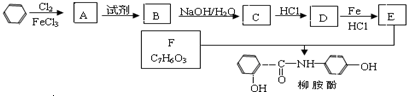
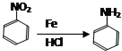
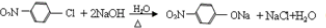 .
.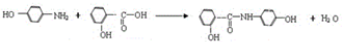 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| B. | Al2O3熔点高,可用作耐高温材料 | |
| C. | 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板 | |
| D. | NaHCO3溶于水呈碱性,可作抗酸药,服用时喝些醋能提高药效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| D. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.4mol/(L•s) | B. | v(B)=0.5mol/(L•s) | C. | v(C)=0.6mol/(L•s) | D. | v(D)=0.7mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com