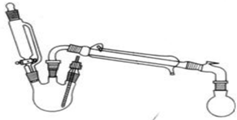
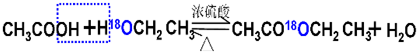
黄铁矿主要成分是FeS
2.某硫酸厂在进行黄铁矿成分测定时,取2.000g样品在空气中充分灼烧(假设杂质不参加反应),将生成的SO
2气体与足量Fe
2(SO
4)
3溶液完全反应后,用浓度为0.3360mol?L
-1的KMnO
4标准溶液滴定至终点,消耗KMnO
4溶液25.00mL.
已知:①4FeS
2+11O
22Fe
2O
3+8SO
2②SO
2+2Fe
3++2H
2O→SO
42-+2Fe
2++4H
+③MnO
4-+5Fe
2++8H
+→Mn
2++5Fe
3++4H
2O
(1)样品中FeS
2的质量分数是
.(用小数表示,保留三位,下同)
(2)煅烧1000t该黄铁矿生产出997.9t硫酸铵,若黄铁矿制取硫酸时的利用率为0.800,则在制取硫酸铵时硫酸的利用率为
.
(3)为使黄铁矿充分燃烧,工业上使用过量空气(设空气中O
2的体积分数为0.200),当空气过量20%时,煅烧后气体中SO
2的体积分数是多少?
(4)若接触室导出的气体中含体积分数为0.0672的SO
3.把出口气体送进吸收塔,用质量分数为0.980的硫酸吸收,可得到“发烟H
2SO
4”(H
2SO
4和SO
3的混合物,其中含质量分数为0.200的SO
3).计算吸收10
3 m
3出口气体(已折算为标准状况)所需要质量分数为0.980的硫酸的质量.



 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案

 .
.