

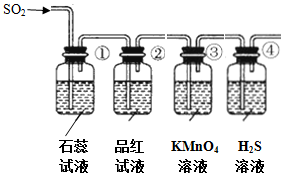
| 序号 | 实验现象 | 解释原因 |
| ① | 石蕊试液变红 | 石蕊试液变红说明SO2是酸性气体 |
| ② | 品红试液褪色 | SO2具有漂白性 |
| ③ | KMnO4溶液颜色褪色 | 反应的离子方程式5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+ |
| ④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
分析 (1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,悬着装置A制备二氧化硫,再用浓硫酸干燥后收集,二氧化硫为有害气体,所以应注意尾气处理;
(2)根据二氧化硫的性质,为酸性气体,能使石蕊变色,有漂白性使品红褪色,具有还原性,能使酸性高锰酸钾褪色,且具有氧化性,能与硫化钠发生价态归中反应生成单质硫;
(3)根据二氧化硫的性质检验即可.
解答 解:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,悬着装置A制备二氧化硫,再用浓硫酸干燥后收集,为干燥彻底,所以b连接C装置的c,二氧化硫密度比空气大,所以收集时导气管应长进短出,二氧化硫为有害气体,所以应用氢氧化钠吸收多余的二氧化硫气体,则连接顺序为:b→c→d→e→f→g,
故答案为:b→c→d→e→f→g;
(2)二氧化硫为酸性气体,所以能使①中石蕊试液变红,具有漂白性,能使②中品红溶液褪色,具有还原性,发生反应5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+,能使③中酸性高锰酸钾褪色,具有氧化性,能与④中硫化钠发生价态归中反应生成硫单质,SO2+2H2S=3S↓+2H2O,④中溶液浑浊,生成淡黄色沉淀;
故答案为:
| 序号 | 实验现象 | 解释原因 |
| ① | 石蕊试液变红 | 石蕊试液变红说明SO2是酸性气体 |
| ② | ||
| ③ | KMnO4溶液颜色褪色 | 5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+ |
| ④ |
点评 本题考查了二氧化硫的制备的性质的探究,涉及实验装置的安排,方程式的书写等知识点,侧重于学生对实验装置的理解以及实验原理的掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中加热胆矾晶体制无水硫酸铜 | |
| B. | 用向下排空气法收集 NO2 气体 | |
| C. | 用 K3[Fe(CN)6]溶液检验 FeCl2 溶液中的 Fe2+ | |
| D. | 将 CO2 与 HCl 混合气体通过碱石灰可得到纯净的 CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 不能用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 | |
| D. | 轮船水线以下的船壳上装有锌块能减缓船壳的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z以质量比7:16组成的共价化合物有两种 | |
| B. | X和Y、X和Z组成的常见化合物,稳定性前者大于后者 | |
| C. | X、Z、W简单离子的半径由大到小的顺序为:Z>W>X | |
| D. | X、Y、Z可以组成一种离子化合物,其中X、Y、Z元素原子个数比为4:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
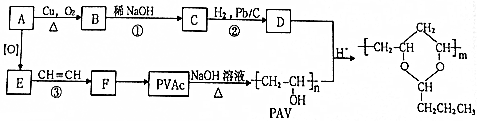

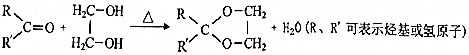
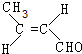 ,该分子中最多有9个原子共平面;
,该分子中最多有9个原子共平面; $→_{△}^{NaOH}$
$→_{△}^{NaOH}$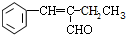 +H2O;
+H2O;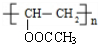 ;
;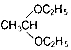 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 常温常压下,1molNO2气体与水完全反应,转移电子数为NA | |
| C. | 标准状况下,11.2LC2H5OH中所含的分子数为0.5NA | |
| D. | 常温常压下,17gNH3中含有的共用电子对数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉是纯净物,其成分就是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 浓盐酸、浓硫酸、浓硝酸都有强氧化性,能氧化金属铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com