
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
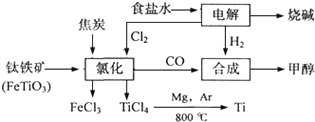
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式:_____________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJmol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJmol﹣1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H=___________________________。反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
(3)在上述产业链中,合成192t甲醇理论上需额外补充H2___________t(不考虑生产过程中物质的任何损失).
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是_____________________________________________________________。
【答案】 2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO ﹣512 kJmol﹣1 Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
2FeCl3+2TiCl4+6CO ﹣512 kJmol﹣1 Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
【解析】(1)钛铁矿经氯化法得到四氯化钛的化学方程式为2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO 。
2FeCl3+2TiCl4+6CO 。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJmol﹣1;②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJmol﹣1。由①![]() 2-②可得2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s),则该反应的△H=(﹣641kJmol﹣1)
2-②可得2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s),则该反应的△H=(﹣641kJmol﹣1) ![]() 2-(﹣770kJmol﹣1)=﹣512 kJmol﹣1。反应2Mg+TiCl4
2-(﹣770kJmol﹣1)=﹣512 kJmol﹣1。反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是:Mg和Ti都有强还原性,在Ar气氛中可以防止其被氧化。
2MgCl4+Ti在Ar气氛中进行的理由是:Mg和Ti都有强还原性,在Ar气氛中可以防止其被氧化。
(3)合成甲醇的反应为CO+2H2→CH3OH,在上述产业链中,不考虑生产过程中物质的任何损失,合成192t甲醇理论上需CO的质量为![]() ,需要H2的质量为
,需要H2的质量为![]() 。由2FeTiO3+6C+7Cl2
。由2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO可知,制备168t CO需要氯气的质量为
2FeCl3+2TiCl4+6CO可知,制备168t CO需要氯气的质量为![]() ,电解饱和食盐水制备497t氯气的同时,可以获得氢气的质量为
,电解饱和食盐水制备497t氯气的同时,可以获得氢气的质量为![]() ,所以需要额外补充H2 10t.
,所以需要额外补充H2 10t.
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的总反应为2CH3OH+3O2+4OH﹣=2CO32﹣+6H2O,正极反应式为3O2+12 e﹣+6H2O=12OH﹣,所以其负极上的电极反应式是2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O。


科目:高中化学 来源: 题型:
【题目】下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号_________, 元素⑥的原子结构示意图____________________。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________, 该化合物中含有的化学键是_____________________。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________(写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
Ⅳ | |
4 | Ge |
5 | Sn |
6 | Pb |
请解释产生上述性质变化的原因______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同主族元素随着原子序数的递增,下列说法正确的是
A.单质熔沸点逐渐降低B.金属单质的还原性逐渐减弱
C.原子半径逐渐增大D.元素的非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸦片最早用于药物(有止痛、止泻、止咳的作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短.鸦片具有复杂的组成,其中的罂粟碱的分子结构如下: 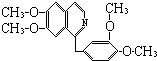 已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
A.23.25mol 5
B.24.5mol 7
C.24.5mol 8
D.23.25mol 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是
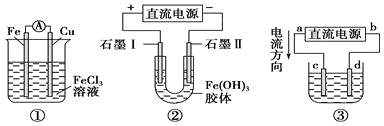
A. 装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B. 装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C. 装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D. 若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-═IO3-+5I-+3H2O下列说法不正确的是( )
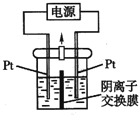
A. 右侧发生的电极方程式:2H2O+2e-═H2↑+2OH-
B. 电解结束时,右侧溶液中含有IO3-
C. 电解槽内发生反应的总化学方程式:![]()
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
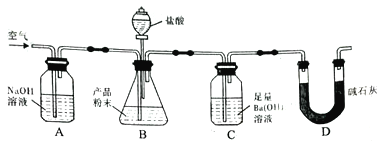
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com