
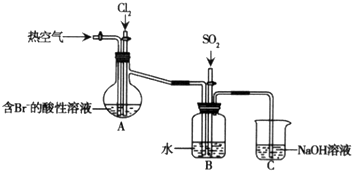
分析 (1)装置A中通入Cl2的目的可氧化溴离子;
(2)修溴质易挥发,热空气可将生成的溴蒸气吹出;
(3)在B装置中发生氧化还原反应生成硫酸和HBr,说明Br2有氧化性;
(4)氯水中氯气氧化溴离子、碘离子为单质,碘单质遇到淀粉变蓝色.
解答 解:(1)加入的Cl2能和溴离子发生反应生成溴单质,氯气能和溴离子发生置换反应生成溴单质,离子反应方程式为Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:吹出Br2;
(3)使溴蒸气转化为氢溴酸以达到富集的目的,可知气体SO2和Br2发生的反应为Br2+SO2+2H2O=2HBr+H2SO4,反应中溴单质具有氧化性,
故答案为:氧化;
(4)溶液中有溴单质,氧化碘离子为碘单质,氯水中氯气氧化溴离子、碘离子为单质,碘单质遇到淀粉变蓝色,不能证明反应后的装置B中含有Br-,
故答案为:不合理,因为过量的氯水也可使溶液变蓝.
点评 本题考查海水资源开发利用及海水提溴,为高频考点,涉及氧化还原反应、离子反应及流程分析,注重基础知识的综合运用,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易液化 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
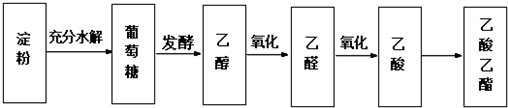
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
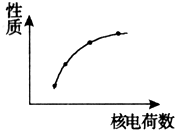 如图表示第IA族的金属元素的某些性质随核电荷数的变化关系.下列各性质中不符合图示关系的是( )
如图表示第IA族的金属元素的某些性质随核电荷数的变化关系.下列各性质中不符合图示关系的是( )| A. | 金属性 | B. | 阳离子的氧化性 | ||
| C. | 单质与水反应的剧烈程度 | D. | 最高价氧化物对应的水化物的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | FeCl3溶液的配制需先将固体FeCl3溶解在盐酸中,再加水稀释到相应浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氧酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
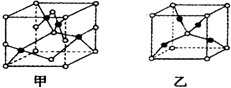 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com