
分析 (1)发生反应:Fe3O4+4CO=3Fe+4CO2,根据盖斯定律书写目标热化学方程式;
(2)①可逆反应到达平衡时,正、逆反应速率相等,各组分的浓度、含量不变,由此衍生的一些其它物理量不变,注意判断平衡的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
②利用三段式计算平衡时各组分浓度、各组分浓度变化量,进而计算CO的转化率;
③根据v=$\frac{△c}{△t}$计算v(CO2);
④欲提高该反应中CO的平衡转化率,应改变条件使平衡向正反应方向移动,结合平衡移动原理方向,注意反应前后气体的体积不变;
⑤结合②中的计算,代入平衡常数K=$\frac{{c}^{4}(C{O}_{2})}{{c}^{4}(CO)}$计算.
解答 解:(1)已知:①Fe3O4(s)+4C(石墨)?3Fe(s)+4CO(g)△H=+646.0kJ/mol
②C(石墨)+CO2(g)?2CO(g)△H=+172.5kJ/mol
根据盖斯定律,①-②×4可得Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g),故△H=+646.0kJ/mol-4×(+172.5kJ/mol)=-44.0kJ/mol,故反应热化学方程式为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol,
故答案为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol;
(2)对应可逆反应:Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol,
①a.反应前后气体的体积不变,容器内压强始终不变化,压强不变化不能说明到达平衡,故a错误;
b.容器内CO、CO2物质的量比与CO的转化率有关,平衡时不一定为1:1,故b错误;
c.气体有CO转化为二氧化碳,气体的质量增大,容器内气体的质量不再变化,说明反应到达平衡,故c正确;
d.生成CO2的速率与消耗CO的速率相等,均表示正反应速率,反应始终按速率之比为1:1进行,故d错误,
故答案为:c;
②T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0mol,10min反应达到平衡时,容器中CO2的浓度是0.4mol/L,则:
Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)
开始(mol/L):0.5 0
转化(mol/L):0.4 0.4
平衡(mol/L):0.1 0.4
故CO的转化率为$\frac{0.4mol/L}{0.5mol/L}$×100%=80%,
故答案为:80%;
③10min内v(CO2)=$\frac{0.4mol/L}{10min}$=0.04mol/(L.min),
故答案为:0.04mol/(L.min);
④欲提高该反应中CO的平衡转化率,应改变条件使平衡向正反应方向移动,
a.正反应为放热反应,提高反应温度,平衡向逆反应方向移动,CO的转化率降低,故a错误;
b.移出部分CO2,平衡向正反应方向移动,CO的转化率增大,故b正确;
c.加入合适的催化剂,同等程度增大正、逆反应速率,缩短到达平衡的时间,平衡不移动,CO的转化率不变,故c错误;
d.减小容器的容积,压强增大,由于反应气体气体的体积不变,平衡不一定,CO转化率不变,故d错误,
故答案为:b;
⑤由平衡时二氧化碳浓度为0.4mol/L,由②中的计算可知,平衡时CO浓度为0.1mol/L,故该稳定性平衡常数K=$\frac{{c}^{4}(C{O}_{2})}{{c}^{4}(CO)}$=$\frac{0.{4}^{4}}{0.{1}^{4}}$=256,
故答案为:256.
点评 本题比较综合,涉及热化学方程式书写、平衡状态判断、反应速率计算、平衡常数计算、化学平衡移动及计算等,注意平衡状态判断中选择判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡,(3)中平衡常数计算时注意:同一反应中化学计量数不同,平衡常数也发生变化,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
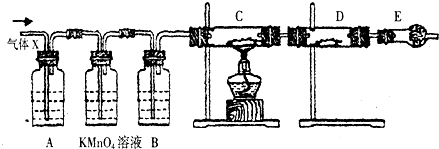
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
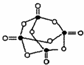 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
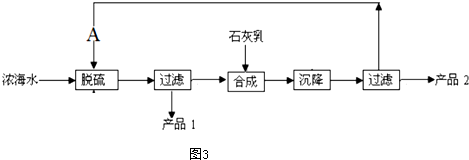
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
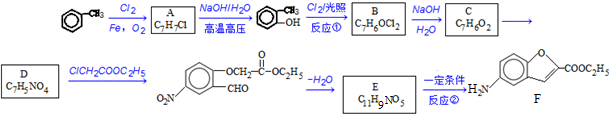
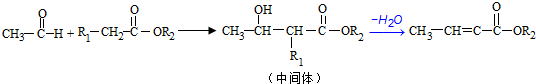
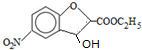 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;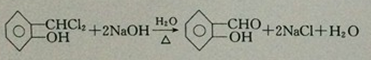 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为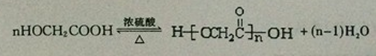 ;
;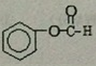 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 操作或现象 |
| A | 制备无水FeCl3 | 将FeCl3溶液加热蒸干 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 证明非金属性Cl>C>Si | 向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D | 测定NaCl中混有Na2CO3的量 | 取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
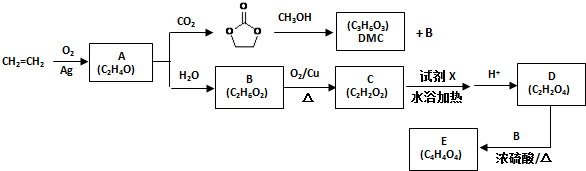
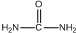 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 +2CH3OH$→_{△}^{催化剂}$CH3OCOOCH3+2NH3↑.
+2CH3OH$→_{△}^{催化剂}$CH3OCOOCH3+2NH3↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com