
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,Fe2+氧化成Fe3+,减少的是亚铁离子,增加的是三价铁离子、钠离子、氯离子,铝离子、硫酸根离子保持不变.
解答 解:溶液中加入过量的Na2O2固体,与水反应生成NaOH和氧气,钠离子增大,Fe2+被氧化成Fe3+,Fe2+减少;
Fe3+、Al3+均与碱反应,铝离子转化为偏铝酸根离子,Fe3+转化为氢氧化铁,再通入过量的稀盐酸,溶液中氢氧化铁转化为铁离子,铁离子增多,偏铝酸根离子转化为铝离子,铝离子保持不变;
由于过氧化钠与水反应生成钠离子,加盐酸引入氯离子,则Na+、Cl-数目不变,
则只有Al3+、SO42-不变,
故选A.
点评 本题考查离子共存及离子反应,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意过氧化钠的强氧化性,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 青蒿素可溶于乙醚和水 | |
| B. | 青蒿素的晶体为分子晶体,化学式为C16H20O5 | |
| C. | 青蒿素与NaOH溶液不反应 | |
| D. | 青蒿素含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
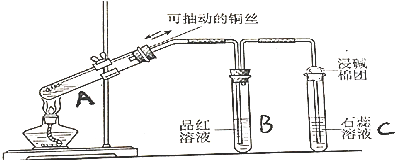
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日光照射下,NO2与空气中的一些碳氢化合物发生作用会产生光化学烟雾 | |
| B. | 研制性能优良的催化剂可使反应所需温度降低,加快反应速率,起到很好的节能效果 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃两个不同的反应条件下△H不同 | |
| D. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O)进行消毒、净化,以改善水质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
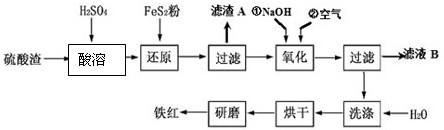
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:推断题
甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体。它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为_____________(填化学式)。
(2)1mol乙和足量甲反应可生成______________mol B物质;1mol丙和足量甲反应可生成____________mol B物质。
(3)D能使湿润的有色布条褪色,其褪色原因是_______________。(结合化学反应方程式描述原因)
(4)丙与溶液F反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl + H2O = H3O+ + Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4) = 6.3 × 10-9 ,Ka(HNO3) = 4.2 × 10-10。 下列说法正确的是
A.冰醋酸中H2SO4的电离方程式:H2SO4 + 2CH3COOH = SO42-+ 2CH3COOH2+
B.H2SO4的冰醋酸溶液中:c(CH3COOH2+) = c(HSO4-)+ 2c(SO42-) + c(CH3COO-)
C.浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)> pH(HNO3)
pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸,c(CH3COOH2+)/c(HNO3)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com