
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
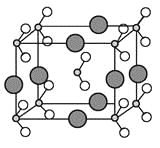
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
【答案】(1)[Ar]3d104s1 (2)N>O>C (3)高于
B的氢化物分子之间存在氢键 (4)[N=C=O]- (5)sp
(6)NaNO2 (7)Cu+外围电子3d10轨道全满稳定,Cu2+外围电子3d9轨道电子非全满和半满状态不稳定,所以CuO在加热条件下容易转化为Cu2O
【解析】试题分析:原子序数依次增大的A、B、C、D、E、F六种元素,A的基态原于有3个不同的能级,各能级中的电子数相等,则A是C元素;C的基态原子2p能级上的未成对电子数与A原子的相同,C原子序数大于A,则C为O元素;B原子序数大于A而小于C,则B是N元素;E和C位于同一主族,且E原子序数小于29,则C是S元素;D为它所在周期中原子半径最大的主族元素,原子序数小于S,则D是Na元素;F的原子序数为29,为Cu元素;
(1)F是Cu元素,其原子核外有29个电子,根据构造原理知Cu元素基态原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)A、B、C分别是C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以电离能从小到大顺序是N>O>C;
(3)含有氢键的氢化物熔点较高,氨气分子中含有氢键、甲烷中不含氢键,所以氨气熔沸点高于甲烷;
(4)等电子体原子个数相等、价电子数相等,由C、N、O形成的离子OCN-与CO2互为等电子体,根据二氧化碳结构式知OCN-的结构简式为[N=C=O]-;
(5)在元素C与S所形成的常见化合物CS2中,二硫化碳分子中中心原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;
(6)由N、O、Na三种元素形成的化合物晶体的晶胞如图所示,该晶胞中N原子个数=1+8×1/8=2、O原子个数=2+16×1/8=4,Na原子个数=8×1/4=2,所以该晶胞中Na、N、O原子个数之比=2:2:4=1:1:2,则化学式为NaNO2;
(7)在原子中电子层全满、半满和全空为稳定状态,Cu+外围电子3d10轨道全满稳定,Cu2+外围电子3d9轨道电子非全满和半满状态不稳定,所以CuO在加热条件下容易转化为Cu2O。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍。下列说法不正确的是( )
A. 原子半径:Y>X,离子半径Z<W
B. 元素Y的单质能与元素X的最高价氧化物发生置换反应
C. 元素Y和W能形成YW2型离子化合物
D. W的单质有毒,能使湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证盐酸、碳酸和硅酸的酸性强弱,用如图装置进行实验: 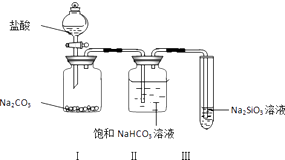
回答下列问题.
(1)装置Ⅰ中的现象是装置Ⅱ的作用是 , 其中可能发生反应的离子方程式是 .
(2)装置Ⅲ中的现象是 , 反应的化学方程式是 .
(3)该实验的实验结论是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
4NO(g) + 6H2O(g),下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
A. v(O2)= 0.24 mol·L-1·s-1 B. v(NH3)=0.2 mol·L-1·s-1
C. v(H2O)=0.25 mol·L-1·s-1 D. v(NO) = 0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关。下列叙述错误的是( )
A.有机玻璃的主要成分是硅酸盐和二氧化硅
B.硫酸亚铁与维生素C混用有利于铁元素吸收
C.汗水浸湿的衣服晾干后的白色斑迹主要是氯化钠
D.通过石油的裂解可以得到乙烯、丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
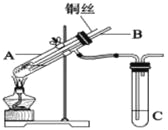
A中装置体现了浓硫酸的哪些性质?______;
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在______(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过______、______、过滤、洗涤、干燥,即可得到产品CuSO45H2O晶体,干燥时需要控制温度小于100℃,若温度过高,则会导致______.
(3)探究小组用滴定法测定某胆矾晶体中CuSO4的含量.取ag样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用c molL﹣1的EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+.
①写出计算CuSO4质量分数的计算式ω=______;
②下列操作会导致CuSO4含量的测定结果偏低的是______.
a.用样品溶液润洗锥形瓶
b.滴定终点时俯视读数
c.滴定终点时滴定管尖嘴中有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。试写出:
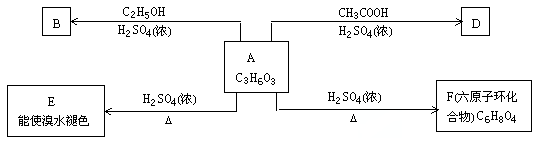
(1)化合物的结构简式:A ;B ;D
(2)化学方程式: A→E ;A→F
反应类型: A→E ;A→F
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com