
【题目】下列各组物质中,反应后生成碱和氧气的是( )
A.Na和H2OB.Na2O和H2OC.Na2O2和CO2D.Na2O2和H2O
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,它们虽会对环境造成负面影响,但也是重要的化工原料,其回收利用是环保领域研究的热点课题。
(1)CO 与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L 的密闭容器中投入一定量的CO与Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH=a kJ/ mol。
COCl2(g) ΔH=a kJ/ mol。
反应过程中测定的部分数据如下表:
t/ min | n (CO) /mol | n (Cl2) /mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应从开始到2min 末这一段时间内的平均速率v(COCl2)=_____mol/(L·min)。
②在2min~4min 间,v (Cl2) 正______v (Cl2)逆(填“>”、“<”或“=”),该温度下K=_______。
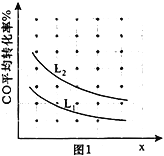
③已知X、L可分别代表温度或压强,图1表示L不同时,CO的转化率随X的变化关系。L代表的物理量是_____________;a_________0(填“>”、“<”或“=”)。
(2)在催化剂作用下NO和CO 可转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
①已知: N2(g)+O2 (g)=2NO(g) △H1= +180.0kJ/mol
2C(s)+O2 (g)=2CO (g) △H2= -221.0 kJ/mol
2C(s)+2O2 (g)=2CO2 (g) △H3= -787.0 kJ/mol
则ΔH=____________。
②研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验(实验条件已经填在下面的实验设计表中)。实验的设计目的是___________________________。
实验编号 | T(℃) | NO初始浓度 (mol L-1) | CO初始浓度 (mol L-1) | 催化剂的比表面积(m2 g-1) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
(3)在强酸性的电解质水溶液中,惰性材料作电极,电解CO2可得到多种燃料,其原理如图2 所示。
①b 为电源的_______(填“正”或“负”)极,电解时,生成丙烯的电极反应式是_________。
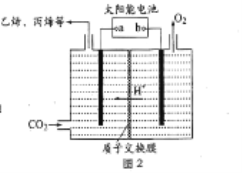
②侯氏制碱法中可利用CO2、NH3、NaCl等为原料先制得NaHCO3,进而生产出纯碱。已知H2CO3 的Ka1=4.3×10-7 molL-1、Ka2=5.6×10-11 molL-1,NaHCO3溶液中各离子浓度由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( )
A. BaSO4的溶度积常数比BaCO3的小
B. SO![]() 没有毒性,CO
没有毒性,CO![]() 有毒性
有毒性
C. BaSO4的密度大
D. 胃酸能与CO![]() 结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
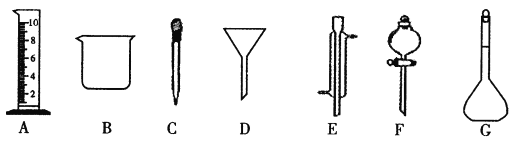
(1)写出仪器名称:E_____________,F_____________。
(2)下列实验操作中用到仪器D的是_________(选填下列选项的编号字母 )。
A.分离水和CC14的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物
Ⅱ.某课外兴趣小组需要200mL1mol/L的Na2CO3溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
应称取Na2CO3的质量 | 应选用容量瓶的规格 | 除容量瓶外还需要的其它玻璃仪器是上图中的______、_____及玻璃棒 |
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)______________。
A.将已冷却的溶液沿玻璃棒注入容量瓶中
B.用托盘天平准确称量所需Na2CO3的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C.用适量水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
D.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E.将容量瓶盖紧,振荡,摇匀
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
没有进行C操作________;配制溶液时,容量瓶未干燥_________;定容时俯视刻度线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在研究生物体的化学成分时,发现组成生物体的元素在非生物界都存在,这一事实说明 ( )
A. 生物界和非生物界没有区别 B. 组成生物的物质来源于非生物
C. 生物界和非生物界具有统一性 D. 生物界和非生物界具有差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物等杂质):
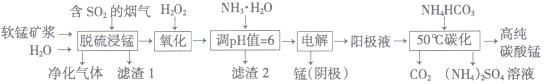
已知:Fe(OH)3的Ksp=l.0×10-38,Al(OH)3的Ksp=1.0×10-34
(1)一定温度下, “脱硫浸锰”主要产物为MnSO4,生成该产物的化学方程式为_________。
(2)常温下,调节pH=6时,得到的“滤渣2”主要成分为Fe(OH)3和_____(化学式),此时溶液中的Fe3+物质的量浓度为_________ 。
(3)“电解”时用惰性电极,阳极的电极反应式为_______________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程武为____________________。“50℃碳化”时加入过量NH4HCO3,可能的原因:①使MnSO4充分转化为MnCO3;②________________;③________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=l0c2
C. pH =11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. NaHCO3溶液中有:HCO3-+H2O![]() CO32-+H3O+加水稀释后,H+浓度减小
CO32-+H3O+加水稀释后,H+浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com