
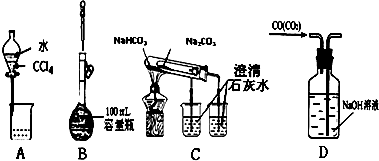
| A. | 分离水和CCl4 | B. | 定容 | ||
| C. | 比较两种盐的热稳定性 | D. | 除去CO的CO2 |
分析 A.水和CCl4分层,水在上层;
B.加水至刻度线1~2cm处改用胶头滴管定容;
C.碳酸氢钠不稳定,加热易分解;
D.除杂时导管应长进短出.
解答 解:A.水和CCl4分层,水在上层,可利用分液漏斗分离,故A正确;
B.加水至刻度线1~2cm处改用胶头滴管定容,则加水太少,还不能定容,故B错误;
C.碳酸氢钠不稳定,加热易分解,则为了对比性,应在温度低的小试管中加碳酸氢钠,故C错误;
D.除杂时导管应长进短出,图中气体的进入方向不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物的分离提纯、溶液配制、稳定性比较等,把握实验技能、实验原理及实验装置为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若A为O2,B为O3,它们质量相等时则容器中氧原子个数不相等 | |
| B. | 若A为NO2,B为N2O4,它们压强相等时则质量相等 | |
| C. | 若A为C2H4,B为C2H6,它们密度相等时则气体的物质的量相等 | |
| D. | 若A为CO2,B为C3H8,它们密度相等时则分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置:除去Cl2中的HCl杂质 装置:除去Cl2中的HCl杂质 | |
| B. |  装置:制取乙酸乙酯 装置:制取乙酸乙酯 | |
| C. |  装置:用酒精萃取碘水中的碘单质 装置:用酒精萃取碘水中的碘单质 | |
| D. |  烧瓶中充满氨气,烧杯中盛装四氯化碳,可产生喷泉现象 烧瓶中充满氨气,烧杯中盛装四氯化碳,可产生喷泉现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和浓HNO3反应 | B. | Cu和稀HNO3反应 | ||
| C. | 先把Cu粉氧化,再用稀HNO3溶解CuO | D. | 上述任何方法都一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com