
| A. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
分析 A.溶液中存在电荷守恒分析,阴阳离子所带电荷总数相同;
B.小苏打溶液中溶质碳酸氢钠,其中碳酸氢根离子水解溶液显碱性;
C.PH=-lgc(H+),c(H+)=10-PH;
D.50℃时,溶液中离子积常数不是10-14.
解答 解:A.溶液中存在电荷守恒,c(Na+)+c(H+)=c(Cl-)+c(OH-),故A正确;
B.小苏打溶液中溶质碳酸氢钠,其中碳酸氢根离子水解溶液显碱性,饱和小苏打溶液中:c(Na+)>c(HCO3-),故B错误;
C.PH=-lgc(H+),c(H+)=10-PH =10-4mol/L,故C错误;
D.50℃时,离子积常数大于10-14,溶液中离子积常数不是10-14,pH=12的纯碱溶液中:c(OH-)>1.0×10-2mol•L-1,故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较,溶液中电荷守恒,溶液PH计算,主要是溶液中离子积常数的影响因素分析判断,题目难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
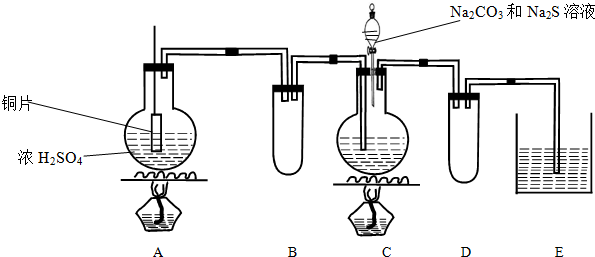
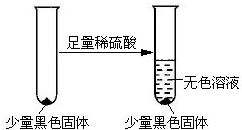
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS04•7H20-绿矾 | B. | Na2O2-火碱 | C. | BaC03-重晶石 | D. | C6Hl206-庶糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
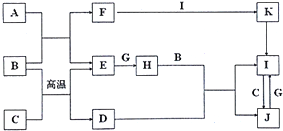
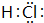
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与过量的稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 氧化铝与氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3OH-→Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋可以作为防腐剂和调味剂 | B. | 味精可作调味剂 | ||
| C. | 甲醛是一种很好的食品防腐剂 | D. | 苯甲酸钠可用作食品添加剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com