
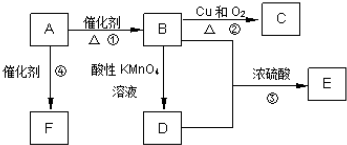
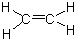 ,C的名称为乙醛,
,C的名称为乙醛, ;乙醛;
;乙醛; ,该反应属于加成反应;
,该反应属于加成反应; ,该反应属于加聚反应,
,该反应属于加聚反应, ;加成反应;
;加成反应; ;加聚反应.
;加聚反应.


科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X(g)+3Y(g)?2Z(g) |
| C、增大压强可使平衡向生成Z的方向移动,平衡常数增大 |
| D、改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
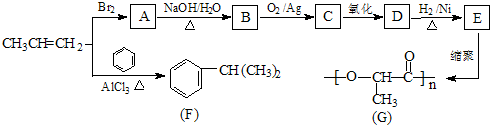
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:查看答案和解析>>
科目:高中化学 来源: 题型:
 利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2,其它条件相同的情况下,使用不同催化剂(Ⅰ,Ⅱ,Ⅲ),CH4的产量随光照时间的变化如图所示.
利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2,其它条件相同的情况下,使用不同催化剂(Ⅰ,Ⅱ,Ⅲ),CH4的产量随光照时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
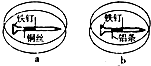 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和| A、a中铁钉发生还原反应 |
| B、b中铁钉附近呈现红色 |
| C、a中铜丝附近呈现蓝色 |
| D、b中铝条附近有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
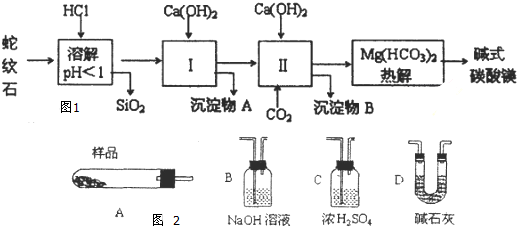
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
沉淀完全时PH | 3.2 | 5.4 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
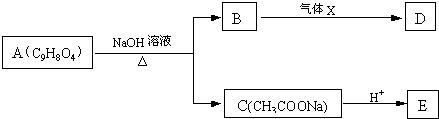
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com