
下列分子或离子在指定的分散系中能大量共存的一组是
A.溴水溶液:Na+、K+、NO3—、CH3CHO
B.氢氧化钠溶液:AlO2—、K+、Cl—、NO3—
C.氢氧化铁胶体:H+、K+、S2—、Cl—
D.高锰酸钾溶液:H+、Na+、SO42—、CH3CH2OH
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是
A.过氧化钠投入水中: 2Na2O2 + 2H2O=4Na+ + 4OH-+ O2↑
B.二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O
C.碳酸钙溶于盐酸 CO32- + 2H+=H2O + CO2↑
D.向氯化亚铁溶液中滴入氯水: Fe2+ + Cl2=Fe3++ 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y是原子序数依次增大的同一短周期元素。W、X是金属元素, 它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍, W与Y可形成化合物W2Y。下列说法正确的是
A.Y的低价氧化物与O3漂白的原理相同
B.Y的氢化物和W2Y所含化学键的类型相同
C.上述三种元素形成的简单离子,X离子半径最小
D.工业上常用电解相应的盐溶液制备W、X的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
把少量废铁屑溶于过量稀硫酸中,充分搅拌并过滤,在滤液中加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为:
A. Fe(OH)2;FeO B. Fe(OH)3 ;Fe2O3
C. Fe(OH)2、Fe(OH)3、Fe3O4 D. Fe2O3 、Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
某城市某河道两旁有甲乙两厂,它们排放的工业废水中共含有K+、Ag+、Fe3+、CL-、OH-、NO3-六种离子。
⑴甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子是 、 、 ;



 ⑵乙厂的废水中含有另外的三种离子。如果加入一定量的 (填“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金属是 ,因为 (用离子方程式表示)
⑵乙厂的废水中含有另外的三种离子。如果加入一定量的 (填“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金属是 ,因为 (用离子方程式表示)


 ⑶有人提出一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填离子符号)转化为沉淀,经过滤后的废水中主要含有 ,
⑶有人提出一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填离子符号)转化为沉淀,经过滤后的废水中主要含有 ,
(填离子符号)所以可用来浇灌农田。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组讨论甲、乙、丙、丁四种实验装置的有关用法,其中不正确的是( )

A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是使水能顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:从①口进气可收集二氧化碳,从②口进气可收集氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
B.常温常压下,1g氧气含O2分子数目为
C.1mol Na2O2晶体中含阴、阳离子总数为4NA
D.高温高压下合成1mol NH3,要断裂的H—H键数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子。
(1)C的元素符号是 ;元素F在周期表中的位置 。
 (2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
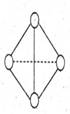
(3)C4气态分子结构如图所示,已知断裂1molC-C吸收l67KJ的热量,
生成lmol C C放出942KJ热量。试写出由C4气态分子变成C2气态分
C放出942KJ热量。试写出由C4气态分子变成C2气态分
子的热化学方程式 。
(4)某盐x (C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分
步水解而呈弱酸性。
① 盐x显酸性原因(用离子方程式表示) 。
② 写出足量金属镁加入盐x的溶液中所发生反应的化学方程式
。
(5)E所在周期中原子半径最大的元素与D元素可形成化合物у,酚酞试液遇у先变红后褪色,写出等物质的量的у与FeSO4投入水中恰好完全反应的离子反应方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
酸雨的形成主要是由于( )
A.森林遭到乱砍滥伐,破坏了生态环境
B.含硫化石燃料的大量燃烧和汽车尾气的大量排放
C.大气中二氧化碳的含量增加
D.塑料制品的大量使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com