
分析 ①制备玻璃的原料为:石灰水、纯碱和石英,工业设备为玻璃窑,发生反应:碳酸钠与二氧化硅在高温下生成硅酸钠和二氧化碳,碳酸钙与二氧化硅在高温下生成硅酸钙和二氧化碳;
②二氧化硅为石英玻璃主要成分;有机玻璃(聚甲基丙烯酸甲酯),据此名称得出此为塑料,塑料为合成的高分子化合物,是由甲基丙烯酸甲酯发生聚合反应生成;
解答 解:①制备玻璃的原料为:石灰水、纯碱和石英,工业设备为玻璃窑,发生反应:碳酸钠与二氧化硅在高温下生成硅酸钠和二氧化碳,碳酸钙与二氧化硅在高温下生成硅酸钙和二氧化碳,化学方程式:Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑;CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ CaSiO3+CO2↑;
故答案为:玻璃窑;Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑;CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ CaSiO3+CO2↑;
②二氧化硅为石英玻璃主要成分,化学式为SiO2;有机玻璃(聚甲基丙烯酸甲酯),据此名称得出此为塑料,塑料为合成的高分子化合物,是由甲基丙烯酸甲酯发生聚合反应生成;
故答案为:SiO2;塑料;聚合反应.
点评 本题考查生活中常见材料,熟悉常见的硅酸盐材料、高分子材料的组成是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 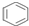 中含碳碳双键数为3NA 中含碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生BaSO4白色沉淀,溶液变红色 | B. | 产生BaSO3白色沉淀,溶液变无色 | ||
| C. | 无沉淀产生,溶液变无色 | D. | 产生BaSO4白色沉淀,溶液变无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com