
| A、CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B、某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥中可以是由KCl饱和溶液制得的琼脂 |
| C、因为铁的活动性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 |
| D、理论上说,任何能自发进行的氧化还原反应都可被设计成原电池 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 通电 |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )| A、将熔融CaF2-CaO换成Ca(NO3)2溶液也可以达到相同目的 |
| B、阳极的电极反应式为:C+2O2--4e-═CO2↑ |
| C、在制备金属钛前后,整套装置中CaO的总量减少 |
| D、若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
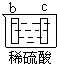
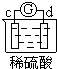
| 实验装置 | 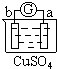 |
 |
 |
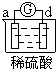 |
| 部分实验现象 | a极质量减小 b极质量增加 |
b极有气体产生 c极无变化 |
d极溶解 c极有气体产生 |
电流计指示在导线中 电流从a极流向d极 |
| A、a>b>c>d |
| B、b>c>d>a |
| C、d>a>b>c |
| D、a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
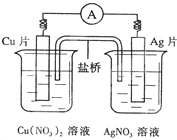
| A、电子沿导线由Cu片流向Ag片 |
| B、正极的电极反应是Ag++e-=Ag |
| C、Cu片上发生氧化反应,Ag片上发生还原反应 |
| D、盐桥中盛装的是含琼脂的饱和氯化钾溶液,钾离子移向硝酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:10 | B、1:20 |
| C、1:200 | D、1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯b中发生反应为2Zn-4e-=2Zn2+ |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水的电离平衡曲线如图所示.下列说法正确的是( )
水的电离平衡曲线如图所示.下列说法正确的是( )| A、水的电离常数KW数值大小关系为:b<c<d |
| B、a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- |
| C、温度不变,加入少量NaOH可使溶液从c点变到 a点 |
| D、在b点对应温度下,将pH=2的HCl与pH=10的NaOH溶液等体积混合后,溶液显中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com