
【题目】下列各组热化学方程式中,化学反应的△H 前者小于后者的是
①C(s)+O2(g)═CO2(g)△H1 C(s)+![]() O2═CO(g)△H2
O2═CO(g)△H2
②S(g)+O2(g)═SO2(g)△H3 S(s)+O2(g)═SO2(g)△H4
③2H2(g)+O2(g)═2H2O(l)△H5 H2(g)+![]() O2(g)═H2O(l)△H6
O2(g)═H2O(l)△H6
④CaCO3(s)═CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)═Ca(OH)2(s)△H8
A.①④B.④C.②③④D.①②③
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[硫酸亚铁铵,(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定,易溶于水,难溶于乙醇。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。

回答下列问题:
Ⅰ.制取莫尔盐
i.连接装置,检査装置气密性。将13.2g(NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。
ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。
iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。
iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。
(1)仪器a的名称是___。
(2)操作iii中浅绿色溶液会流入B的原因是___。
(3)操作iv中洗涤晶体所用试剂是___(填标号)。
A.水 B.无水乙醇 C.硫酸溶液
Ⅱ.为测定所得莫尔盐晶体纯度,取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。(已知:Cr2O72-还原产物为Cr3+)
(4)写出此反应的离子方程式___。
(5)滴定时必须选用的仪器是___。(填标号)
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。
![]()
(6)莫尔盐晶体纯度为___。(用含m、w的式子表示)
(7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
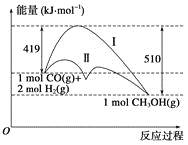
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1807年,英国化学家戴维在研究中发现:电解条件下可把水分解成H2和O2。他设想用电解的方法从KOH、NaOH中分离出K和Na。最初,戴维用饱和KOH溶液进行电解,不料还是得到H2和O2。这时,他考虑在无水条件下继续这项实验,但是,实验中产生的金属液珠一接触空气就立即燃烧起来;这时,他又考虑在________条件下电解熔融的KOH继续实验,最后他终于成功地得到了银白色的金属钾。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
Ⅰ.铷位于元素周期表的第________周期________族。
Ⅱ.关于铷的下列说法中正确的是________(填序号,下同)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳 ③Rb2O2与水能剧烈反应并释放出O2④它是极强的还原剂 ⑤RbOH的碱性比同浓度的NaOH弱
Ⅲ.现有铷和另一种碱金属形成的合金5g,与足量水反应时生成标准状况下的气体2.24 L,则另一碱金属可能是________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
(1)金红石(TiO2)是钛的主要矿物之一,基态Ti原子价层电子的排布图为_________,基态O原子电子占据最高能级的电子云轮廓图为 __________形。
(2)以TiO2为原料可制得TiCl4,TiCl4的熔、沸点分别为205K、409K,均高于结构与其相似的CCl4,主要原因是 __________________。
(3)TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有 ________。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.范德华力
(4)TiCl4可与CH3CH2OH、HCHO、CH3OCH3等有机小分子形成加合物。上述三种小分子中C原子的VSEPR模型不同于其他分子的是 _____,该分子中C的轨道杂化类型为________ 。
(5)TiO2与BaCO3一起熔融可制得钛酸钡。
①BaCO3中阴离子的立体构型为 ________。
②经X射线分析鉴定,钛酸钡的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),则钛酸钡的化学式为 _________。已知晶胞边长为a pm,O2-的半径为b pm,则Ti4+、Ba2+的半径分别为____________pm、___________pm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com