

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
分析 硫酸浸取液中金属离子是Cr3+、Fe3+、Al3+、Ca2+、Mg2+,加入硫酸,将物质溶解酸化,过滤,除去难溶物质,然后向混合液中加入过氧化氢氧化三价铬离子为+6价铬离子,根据表中数据,加入NaOH溶液使溶液呈碱性,调节溶液PH=8,可以将Fe3+、Al3+转化为沉淀除去,将Fe3+、Al3+沉淀完全了,余下的只有Ca2+、Mg2+可以用钠离子交换树脂交换,除去杂质离子,通入二氧化硫还原得到产物,
(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;
(3)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;
硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(3)钠离子交换树脂交换的离子是钙离子和镁离子;
(4)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写;
解答 解:(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是:升高反应温度、增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间;
(3)双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离;
硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离;Fe3+和Al3+;
(4)钠离子交换树脂交换的离子是钙离子和镁离子.
故答案为:Ca2+、Mg2+;
(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平,2Na2CrO4+3SO2+12H2O=2CrOH(H2O)5SO4↓+Na2SO4,
故答案为:1,3,11H2O,2,1;
点评 本题考查了溶液配制、化学方程式的配平、物质的分离、Ksp的有关计算、电解原理的应用等知识点,题目难度中等,注意会运用溶液pH值的调节对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,5-二甲基己烷的核磁氢谱中出现三组峰 | |
| B. | 丙烷分子的比例模型: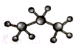 | |
| C. | 四氯化碳分子的电子式: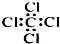 | |
| D. | 化合物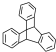 是苯的同系物 是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式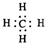 | |
| B. | 氟化钠的电子式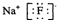 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子 ${\;}_6^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是相邻原子间的相互作用 | |
| B. | 化学键既存在于相邻原子之间,又存在与相邻分子之间 | |
| C. | 化学键通常指的是相邻的两个或多个原子之间的强烈互吸引作用 | |
| D. | 化学键通常是指物质中相邻的原子或离子之间存在的强烈相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤出的固体中一定含有银和铜,一定不含镁 | |
| B. | 滤出的固体中一定含有银,可能含有铜和镁 | |
| C. | 滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜 | |
| D. | 滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应::Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①④⑥ | C. | ①②④⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使湿润KI淀粉试纸变蓝色的气体一定是氯气 | |
| B. | 饱和氯水久置时Cl-增多、水分子减少 | |
| C. | 过量的铁在氯气中燃烧可生成氯化亚铁 | |
| D. | 可用pH试纸测定氯水的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com