
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
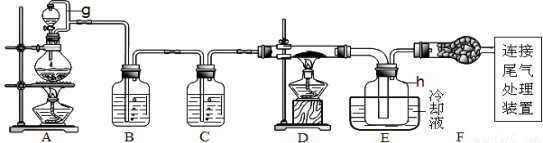
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:2015-2016学年山西省忻州市高一上入学化学试卷(解析版) 题型:选择题
有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④CuCl2,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是
A.④①②③ B.①③④② C.④③②① D.①④②③
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期开学考试化学试卷(解析版) 题型:填空题
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
查看答案和解析>>
科目:高中化学 来源:2016届山东省枣庄市高三9月阶段性学情检测化学试卷(解析版) 题型:填空题
硒和硫是同一主族元素,二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式: 。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2+ KI+ HNO3→ Se+ I2+ KNO3+ H2O
②I2+2Na2S2O3→Na2S4O6+2NaI 配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为___ 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列实验操作及现象能够达到实验目的的是
选项 | 实验操作及现象 | 实验目的 |
A | 溶液中滴加盐酸酸化的氯化钡溶液出现白色沉淀 | 检验溶液中存在SO42- |
B | FeBr2溶液加入少量氯水,溶液有浅绿色变为黄色 | 比较Fe2+、Br-还原性强弱 |
C | 向一定浓度Na2SiO3溶液中通CO2,溶液变浑浊 | 比较C 、Si非金属性强弱 |
D | 溶液中加KSCN溶液,再加氯水,观察溶液是否出现血红色 | 检验Fe3+溶液中是否含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2016届江汉油田海南海政学校高三月考化学试卷(解析版) 题型:计算题
(9分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________;
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄石市高三9月调研考试化学试卷(解析版) 题型:选择题
下列描述中正确的是
A.ClO3-的空间构型为平面三角形
B.SiF4 和 SO32-的中心原子均为 sp3 杂化
C.在所有的元素中,氟的第一电离能最大
D.C2H5OH 分子中共含有 8 个极性键,1 个 π 键
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三7月月考化学试卷(解析版) 题型:选择题
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A.①②③④ B.①③④⑤ C.②④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三9月调考化学试卷(解析版) 题型:选择题
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
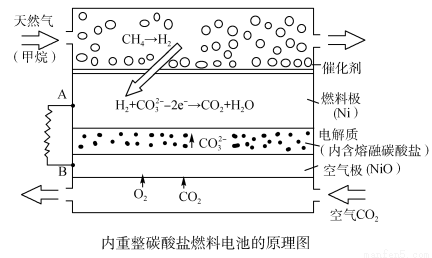
A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B.若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为O2+4e-+2CO2===2CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com