
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
分析 (1)KIO3中I元素的化合价由+5价降低为0,KI中I元素的化合价由-1价升高为0,结合电子守恒及质量守恒定律分析;
(2)①Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式;
②Na2SO3稀溶液与碘的四氯化碳溶液不互溶,分层,要使Na2SO3与碘反应,应充分振荡使其接触;
(3)①溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色;
③根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
解答 解:(1)KIO3中I元素的化合价由+5价降低为0,KI中I元素的化合价由-1价升高为0,由电子守恒及质量守恒定律可知,反应的化学方程式为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:1;5;6H+;3;3H2O;
(2)①Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式,Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+,
故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
②Na2SO3稀溶液与碘的四氯化碳溶液不互溶,分层,要使Na2SO3与碘反应,应充分振荡使其接触.所以在步骤b后,增加操作:将分液漏斗充分振荡后静置,
故答案为:在步骤b后,增加操作;将分液漏斗充分振荡后静置;
(3)①碘遇淀粉变蓝色,所以溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断c中反应恰好完全所依据的现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色,
故答案为:滴入最后一滴溶液时,溶液的蓝色恰好消失,且半分钟内不恢复原色,则达到滴定终点;
②由 KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O32-=2I-+S4O62得,
I~3I2 ~6S2O32
127g 6mol
m(I) 6.0×10-4mol/L×0.02L
解得:m(I)=2.54×10-4g=2.54×10-1mg,
设每千克食盐中含碘xmg,
列比例式为$\frac{2.54×1{0}^{-1}mg}{12.7×1{0}^{-3}kg}$=$\frac{xmg}{1kg}$,
x=20,
故答案为:20.
点评 本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
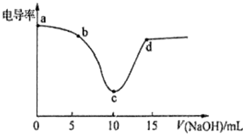
| A. | 电导率传感器能用于判断酸碱中和滴定的终点 | |
| B. | 该过程中,a点所示溶液的导电性最强 | |
| C. | c点电导率最小是因为此时溶液中导电微粒数目最少 | |
| D. | d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
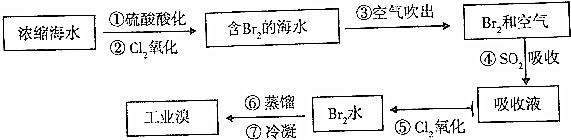
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入的碱溶液体积大 | B. | 酸和碱溶液体积相等 | ||
| C. | 加入的碱溶液体积小 | D. | 以上情况都有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 | |
| B. | 向含少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取,以除去FeCl2溶液中的FeBr2 | |
| C. | 除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 | |
| D. | 除去CuCl2溶液中混有的少量FeCl3,可向溶液中加入CuO后再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
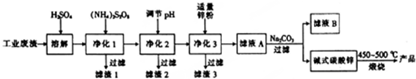
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
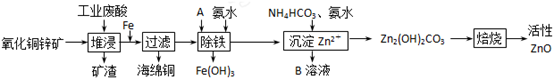
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
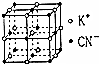 六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:
六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com