
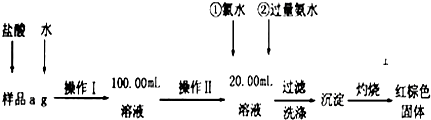
分析 测定铁的质量分数,采取的方法是使样品溶解、然后加入氯水氧化生成铁离子,加入氨水生成氢氧化铁沉淀,最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数.
(1)由图可知,操作I是将加入盐酸反应的溶液稀释成100.00mL溶液,需要烧杯溶解,用玻璃棒搅拌,引流等,定容需要胶头滴管,100ml容量瓶;
(2)加入氨水和铁离子反应生成氢氧化铁沉淀;
(3)不用氯水可以用过氧化氢、次氯酸钠代替做氧化剂,碘水中碘单质不能氧化亚铁离子;
(4)溶液中存在氯化铵,可用硝酸酸化的硝酸银溶液检验最后一次洗涤液中是否存在氯离子,以判断沉淀是否洗净;
(5)氯化铁、氯化亚铁都溶于水,无需加入盐酸;
(6)加热分解所得的物质是Fe2O3,其质量为(W2-W1)g,由于用去20mL溶液,故100mL溶液可以得到Fe2O3质量为5(W2-W1)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数.
解答 测定铁的质量分数,采取的方法是使样品溶解、然后加入氯水氧化生成铁离子,加入氨水生成氢氧化铁沉淀,最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数.
(1)由图可知,操作I是将加入盐酸反应的溶液稀释成100.00mL溶液,玻璃仪器除量筒、100mL的容量瓶外,还必须有溶解的烧杯和玻璃棒,容量瓶定容需要用胶头滴管定容;
故答案为:100mL容量瓶、胶头滴管;
(2)加入氨水和铁离子反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(3)加氯水就是让+2价铁变为+3价,发生反应为:2Fe 2++Cl2=2Fe 3++2Cl-,不用氯水可以用过氧化氢、次氯酸钠代替做氧化剂,碘水中碘单质不能氧化亚铁离子,故AC符合;
故答案为:AC;
(4)溶液中存在氯化铵,可用硝酸酸化的硝酸银溶液检验最后一次洗涤液中是否存在氯离子,方法是取最后一次洗涤液于试管中,滴加少量硝酸银溶液,若无白色沉淀生成,则证明已洗涤干净,
故答案为:取最后一次洗涤液于试管中,滴加少量硝酸银溶液,若无白色沉淀生成,则证明已洗涤干净;
(5)氯化铁、氯化亚铁都溶于水,无需加入盐酸,故答案为:加入盐酸;
(6)因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3的质量为W2-W1g,由于参加反应的溶液只取所配溶液的$\frac{1}{5}$,因此铁元素的质量为5×(W2-W1)g×$\frac{2×56}{160}$,样品中铁元素的质量分数是$\frac{\frac{{W}_{2}-{W}_{1}}{160}×2×56×5}{a}$×100%=$\frac{7({W}_{2}-{W}_{1})}{2a}$×100%;
故答案为:$\frac{7({W}_{2}-{W}_{1})}{2a}$×100%.
点评 本题考查物质含量的测定,涉及溶液配制、离子检验、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:解答题
 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
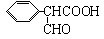 .
.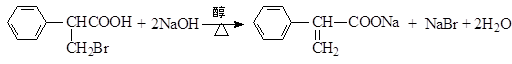 .
.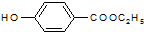 )是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).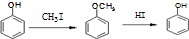
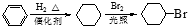
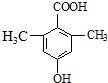 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
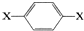 ,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )| A. | 该有机物燃烧时一定只生成CO2和H2O | |
| B. | 该有机物不可能为芳香醇 | |
| C. | 该有机物的分子式可能为C8H10O2 | |
| D. | 该有机物可能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 检验方法 | |
| A | 向沸水中滴加饱和FeCl3溶液,制备胶体 | 用可见光束照射 |
| B | 确认铜与浓硫酸反应生成CuSO4 | 将反应后溶液转入盛有水的烧杯中 |
| C | 区分AgNO3溶液和Al2(SO4)3溶液 | 分别取少量溶液,滴加BaCl2溶液 |
| D | 证明氯水中起漂白作用的不是Cl2 | 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成.都属于置换反应 | |
| B. | 氧化性KClO>Br,还原性Br->CI- | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中2mol还原剂反应则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与1molCl2反应时转移的电子数为3NA | |
| B. | 2g H218O与D216O的混合物中所含中子、电子数目均为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO4溶液10L,含H+的数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com