
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
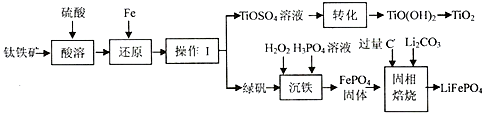
分析 钛铁矿[主要成分为钛酸亚铁(FeTiO)3,含有少量Fe2O3]加硫酸溶解生成TiO2+和Fe3+、Fe2+,加入铁还原铁离子:2Fe3++Fe=3Fe2+,得到硫酸亚铁和TiOSO4,对溶液蒸发浓缩、冷却结晶,过滤得到绿矾晶体和TiOSO4溶液,
将TiOSO4溶液加热,促进TiO2+的水解生成TiO(OH)2,TiO2++2H2O=TiO(OH)2+2H+,分解得到钛白粉(TiO2);
将绿矾与过氧化氢、H3PO4混合沉铁:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,生成的硫酸可以循环利用,将得到的FePO4与过量C、Li2CO3焙烧生成锂离子电池的正极材料LiFePO4:2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑,据此分析解答.
解答 解:(1)FeTiO3中铁元素+2价,氧元素-2价,化合总价为0,则Ti元素+4价;还原“Fe3+”的反应为:2Fe3++Fe=3Fe2+,氧化剂和还原剂之比为2:1;
故答案为:+4;2:1;
(2)由表可知FeSO4溶解度随温度的升高而升高,操作I将FeSO4结晶为绿矾,采用蒸发浓缩、冷却结晶、过滤可得;
故答案为:蒸发浓缩、冷却结晶;
(3)转化为将TiOSO4溶液水解生成TiO(OH)2,对溶液进行加热可加快促进该水解;
故答案为:加快和促进水解;
(4)“沉铁”的为绿矾与过氧化氢、H3PO4混合生成FePO4,离子方程式为:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,己知:ksp (FePO4•2H2O)=9.91×10-16),为使Fe3+完全沉降,则c(Fe3+)c(PO43-)≥ksp (FePO4•2H2O),c(PO43-)≥$\frac{9.91×1{0}^{-16}}{1×1{0}^{-5}}$mol/L=9.91×10-11mol/L;
故答案为:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+;9.91×10-11mol/L;
(5)“沉铁”生成硫酸,可循环利用;FePO4与过量C、Li2CO3焙烧生成锂离子电池的正极材料LiFePO4,铁元素化合价降低,碳元素化合价升高,C过量则生成CO,反应为:2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑;
故答案为:H2SO4;2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑;
(6)充放电过程中,正极发生LiFePO4与FePO4的转化,其中LiFePO4→FePO4的转化化合价降低,发生还原反应,而电池放电时负极发生的反应为:6C+xLi++xe-=LixC6,该反应为氧化反应,所以反应转化应该为:LiFePO4→xLiFePO4,所以电池放电时反应的化学方程式为:xFePO4+LixC6=6C+xLiFePO4;
故答案为:xFePO4+LixC6=6C+xLiFePO4.
点评 本题借助利用钛铁矿制备锂离子电池电极材料流程,为高频考点和高考常见题型,考查了离子方程式书写、电极方程式书写、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸溶液与氨水混合:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 常温下C12与NaOH溶液反应:Cl2+2OH-═C1-+C1O-+H2O | |
| D. | 氢氧化钡溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、H2SO4、S | B. | 金刚石、Na3PO4、Mg | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.
图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,粗铜与外接电源的负极相连 | |
| B. | 纯水中c(H+)=5×10-7mol•L-1,则c(OH-)=2×10-8mol•L-1 | |
| C. | CH3COONH4溶液显中性,说明CH3COONH4中的离子均不发生水解 | |
| D. | 向pH和体积均相同的盐酸和醋酸中各加入少量相同质量的锌粉,后者反应速率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com