
分析 Ⅰ.根据元素周期律的递变规律比较元素、单质以及对应化合物的性质,结合原子结构解答电子数为10的分子;
Ⅱ.根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,以此进行分析.
解答 解:Ⅰ.(1)在原子序数1-18号元素中,与水反应最剧烈的金属是Na,金属性最强,故答案为:Na;
(2)与水反应最剧烈的非金属单质是F2,F元素的非金属性最强,故答案为:F2;
(3)原子半径最小的元素是H,原子核外只有1个电子,故答案为:H;
(4)最稳定气态氢化物对应的元素的非金属性应最强,为HF,故答案为:HF;
(5)电子数为10的分子式有:CH4、NH3、H2O、HF、Ne,故答案为:CH4、NH3、H2O、HF、Ne;
Ⅱ.①H2O中O元素化合价为-2,O原子最外层电子数为6,所以2+6=8,O原子满足8电子结构;H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故①错误;
②BF3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,B原子不满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,故②错误;
③CCl4中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故③正确;
④PCl3中P元素化合价为+3,P原子最外层电子数为5,所以3+5=8,分子中P原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,分子中Cl原子满足8电子结构,故④正确;
⑤SO3中S元素化合价为+6,S原子最外层电子数为6,所以=6+6=12,不满足8电子结构,故⑤错误
⑥N2中,N与N原子之间有3个共用电子对,则N原子的最外层电子为5+3=8,满足8电子稳定结构,故⑥正确;
⑦CO2中,C原子的族序数+成键数=4+4=8,所以满足所有原子最外层为8电子结构,故⑦正确;
故答案为:③④⑥⑦.
点评 本题考查原子结构与元素周期律,比较基础,注意对元素周期律的理解,注意识记常见10电子、18电子微粒,注意利用化合价与最外层电子数来分析是否满足8电子结构,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 18O2中含18个中子 | B. | 18O与16O中子数不同 | ||
| C. | N5和N2互为同位素 | D. | 2 N5=5 N2是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸不稳定,易分解 | |
| B. | 0.1 mol•L-1的亚硝酸溶液的pH<7 | |
| C. | 把pH=2的亚硝酸溶液稀释100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的物质的量 | B. | 升高体系的温度 | C. | 减少C的物质的量 | D. | 增加体系的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
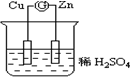 如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL 0.4mol/L NaOH溶液 | B. | 400mL 0.15mol/L Na3PO4溶液 | ||
| C. | 300mL 0.5mol/L NaCl 溶液 | D. | 200mL 0.3mol/LNa2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏 | B. | 煤的干馏 | ||
| C. | 氧气变臭氧 | D. | 乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2SO4的质量是98g•mol-1 | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 0.012kg C-12里所含碳原子个数约为6.02×1023个 | |
| D. | 1mol任何物质的质量等于该物质的相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com