
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):
SiC Si,Si SiO2。
(2)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)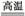 Si(s)+4HCl(g),(已知1 mol Si中含有2 mol Si—Si键)则2 mol H2生成高纯硅需 (填“吸收”或“放出”)能量 kJ。
Si(s)+4HCl(g),(已知1 mol Si中含有2 mol Si—Si键)则2 mol H2生成高纯硅需 (填“吸收”或“放出”)能量 kJ。
【解析】(1)物质熔化时需断键,断键需吸收能量,而键能越大的物质,断键所吸收能量越大,熔点越高。
(2)2 mol H2反应,需1 mol SiCl4,则断裂4 mol Si—Cl键和2 mol H—H键,同时生成1 mol Si和4 mol HCl,则形成2 mol Si—Si键和4 mol H—Cl键。所以吸收能量为360 kJ·mol-1×4 mol+436 kJ·mol-1×2 mol=2 312 kJ,而放出能量为176 kJ·mol-1×2 mol+ 431 kJ·mol-1×4 mol=2 076 kJ,则整个过程能量变化为2 312 kJ-2 076 kJ=+236 kJ。
答案:(1)> < (2)吸收 236


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.烃中没有官能团
B.官能团可以是原子,也可以是原子团
C.官能团决定有机物的特殊性质
D.羟基与氢氧根所含电子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
一个原电池的反应的离子方程式是Zn+Cu2+====Zn2++Cu,该反应的原电池的正确组成是 ( )
| A | B | C | D | |
| 正极 | Zn | Cu | Zn | Fe |
| 负极 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是 ( )
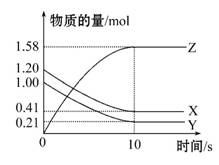
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.10 s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g) 2Z(g)
2Z(g)
D.反应开始到10 s时,平衡反应速率:v(X)=v(Y)=0.039 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于ⅦA族元素的叙述正确的是 ( )
A.ⅦA族元素是同周期中原子半径最大的元素(稀有气体元素除外)
B.ⅦA族元素是同周期中非金属性最弱的元素
C.ⅦA族元素的最高正价都是+7价
D.ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数
查看答案和解析>>
科目:高中化学 来源: 题型:
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
( )
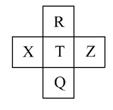
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,电解含有0.02 mol CuSO4和0.04 mol NaCl的混合溶液200mL,当阳极
产生672mL(标准状况下)气体时,假设忽略溶液体积变化,则电解后溶液的PH为( )
A. 1 B.2 C.6 D.7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com