
A、常温下
| ||
| B、向碳酸氢钙溶液中加入过量氢氧化钠溶液发生反应的离子方程式可表示为:Ca2++HCO3-+OH-═CaCO3↓+H2O | ||
| C、加入铝能放出H2的溶液中一定能大量存在Cu2+、Na+、NO3-、C1?四种离子 | ||
| D、常温下将0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
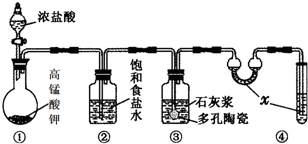 实验室常用以下几种方法制取氯气
实验室常用以下几种方法制取氯气查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| NaOH溶液 |
| △ |
| H+ |
| 一定条件 |
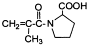 有多种同分异构体,如
有多种同分异构体,如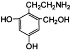 等.写出其中满足下列条件的同分异构体:A.含有苯环,不含甲基;B.能与NaOH溶液以物质的量之比1:1完全中和;C.苯环上一卤代物只有一种,
等.写出其中满足下列条件的同分异构体:A.含有苯环,不含甲基;B.能与NaOH溶液以物质的量之比1:1完全中和;C.苯环上一卤代物只有一种,查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的相对强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
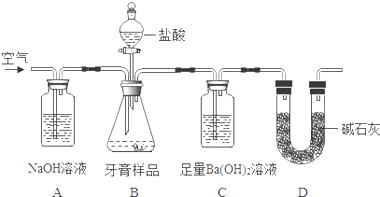
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋除去暖水瓶中的水垢,水垢溶解,有无色气泡产生:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O |
| C、向NaHCO3和CaCl2混合溶液中,加入少量NaOH溶液:OH-+HCO32-═CO32-+H2O |
| D、用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com