
【题目】将 38.4g 铜与适量浓硝酸恰好反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如下图所示:
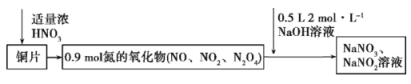
下列有关判断正确的是( )
A. 若浓硝酸体积为 200mL,则其物质的量浓度为 11mol/L
B. NO、NO2、N2O4 和 NaOH 溶液反应时, NO2、N2O4 仅作还原剂
C. 生成 0.2 mol NaNO3 和 0.8 mol NaNO2
D. 硝酸在反应中仅体现氧化性
【答案】A
【解析】
A. 铜和硝酸反应生成硝酸铜和氮的化合物,n(Cu)=38.4/64==0.6mol,生成硝酸铜0.6mol,含有硝酸根离子1.2mol, 氮的化合物为0.9 mol,与氢氧化钠恰好完全反应生成NaNO3 和 NaNO2,根据原子守恒可知:n(Na)=n(N)= n(NaOH)=0.5L×2mol/L=1mol,所以硝酸的总量为1.2+1=2.2 mol,若浓硝酸体积为 200mL,则其物质的量浓度为2.2/0.2=11mol/L, A正确;
B. NO、NO2、N2O4 和 NaOH 溶液反应时生成NaNO3 和 NaNO2,NO2、N2O4中氮元素为+4价,既可升高到+5价,又可降低到+3价, 既作还原剂又作还原剂,B错误;
C.n(Cu)=38.4/64==0.6mol,由电子守恒可以知道,38.4gCu失去的电子等于HNO3到NaNO2得到的电子,0.6×(2-0)= n(NaNO2)×(5-3), 计算得出n(NaNO2)=0.6mol,根据题给信息可知n(NaOH)=0.5L×2mol/L=1mol,则由Na原子守恒可以知道n(NaOH)=n(NaNO2)+n(NaNO3),则n(NaNO3)=1mol-0.6mol=0.4mol,C错误;
D. 铜和硝酸反应生成硝酸铜和氮的化合物,硝酸部分被还原,作氧化剂,有部分生成盐,表现出酸性,D错误;
正确选项A。


科目:高中化学 来源: 题型:
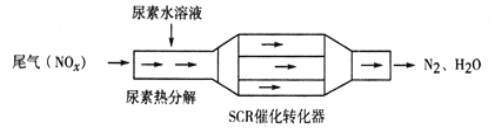
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:
下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2![]() 2N2+12H2O
2N2+12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A. 10 g H2和10 g O2 B. 5.6 L N2和5.6 L CO2
C. 14 g CO和0.5 mol Br2 D. 标准状况下2.24 L H2O和0.1 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的 SO2 和 SO3 相比较,下列结论错误的是
A. 它们的分子数目之比是 1∶1
B. 它们的氧原子数目之比为 2∶3
C. 它们的质量之比为 1∶1
D. 它们所含原子数目之比为 3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 能使甲基橙变红的溶液:Na+、NH4+、NO3-、CO32-
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN-
C. 常温下,![]() =1×10-14的溶液:K+、Na+、AlO2-、CO32-
=1×10-14的溶液:K+、Na+、AlO2-、CO32-
D. 加入Al能放出大量H2的溶液:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨氮(NH3、NH4+)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:![]()
![]()
![]()
![]() N2
N2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
A. 该废水大量直接排放,对水体的影响不大
B. 微生物脱氮时可在高温下进行,以加快脱氮的速率
C. 步骤a发生反应:NH4++2O2=NO3-+H2O+2H+
D. 化学沉淀法脱氮时,溶液的碱性过强,氨氮的去除率将下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.6mol氧气的空气(忽略CO2),放入0.5 L 恒温恒容的密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),测得n(O2)随时间的变化如下表:
2SO3(g),测得n(O2)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | a | a | a |
反应达到5s 后,将容器中的混合气体通入过量的NaOH溶液,气体体积减少了22.4L(已折算为标准状况,忽略吸收O2);再将剩余气体通入过量焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(已折算为标准状况)。请回答下列问题:
(1)用SO2表示从0~1s内该反应的平均反应速率为_______。
(2)反应前容器中SO2的浓度为_______。
(3)混合气体通入过量的NaOH溶液,发生反应的离子方程式为_______。
(4)4s~5s 时,下列说法正确的是_______(填字母)。
A.SO2的生成速率等于O2的消耗速率
B.SO2与O2的浓度比不变
C.混合气体的平均相对分子质量不变
D.该反应已停止
(5)该反应达到平衡时SO2的转化率是_______ (用百分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com