
【题目】某温度下,当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则此状态下,下列热化学方程式正确的是 ( )
①N2(g)+3H2(g) = 2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g) = 2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g) =![]() N2(g)+
N2(g)+![]() H2(g) ΔH=+46.2 kJ/mol
H2(g) ΔH=+46.2 kJ/mol
④2NH3(g) = N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A.①②B.①③C.①②③D.全部
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】根据下面的合成路线图完成下面小题

【1】化合物D的名称为( )
A.乙醇B.乙烷C.葡萄糖D.乙酸
【2】乳酸的一种合成方法如图所示,下列说法正确的是( )
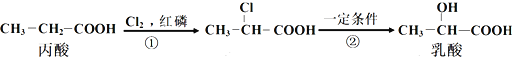
A.步骤①、②分别是加成反应、取代反应
B.蛋白质水解也可生成乳酸
C.丙酸烃基上的二氯代物有2种
D.乳酸与丙烯完全燃烧的产物相同
【3】有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是____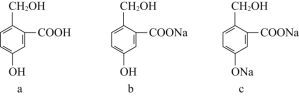
a转化为b | a转化为c | c转化为b | |
A | NaOH | Na | CO2 |
B | Na2CO3 | NaOH | HCl |
C | NaHCO3 | NaOH | CO2 |
D | NaHCO3 | Na2CO3 | HCl |
A.AB.BC.CD.D
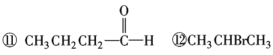
【4】化合物A(C4H8Br2)可由下列反应制得,C4H10O![]() C4H8
C4H8![]() C4H8Br2,则A的结构式不可能的是( )
C4H8Br2,则A的结构式不可能的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是 ( )
A. 混合气体中含NO21.12 L B. 消耗氧气的体积为1.68 L
C. 此反应过程中转移的电子为0.3 mol D. 参加反应的硝酸是0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
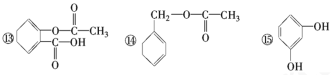
【题目】分析下列有机化合物的结构简式,完成填空。
①CH3CH2CH2CH2CH3②C2H5OH③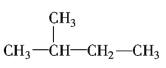 ④
④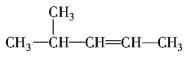 ⑤
⑤![]() ⑥
⑥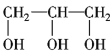 ⑦
⑦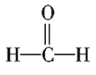 ⑧
⑧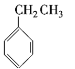 ⑨
⑨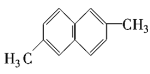 ⑩
⑩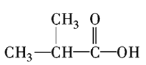
请你对以上有机化合物进行分类,其中,
属于烷烃的是________;属于烯烃的是________;
属于芳香烃的是________;属于卤代烃的是________;
属于醇的是________;属于醛的是________;
属于羧酸的是________;属于酯的是________;
属于酚的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)已知反应:Fe2O3+2Al![]() Al2O3+2Fe,则
Al2O3+2Fe,则
①该反应所属基本反应类型是___。
②在反应中铁元素的化合价变化__(填“升高”或“降低”),该元素的原子__(填“失去”或“得到”)电子。
③发生氧化反应的是__,发生还原反应的是__。
(2)反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中:
①反应中被氧化的元素是__,被还原的元素是___。
②若生成71gCl2,则消耗的HCl是__g,被氧化的HCl是__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
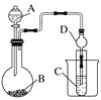
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。某兴趣小组同学用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验,步骤如下:
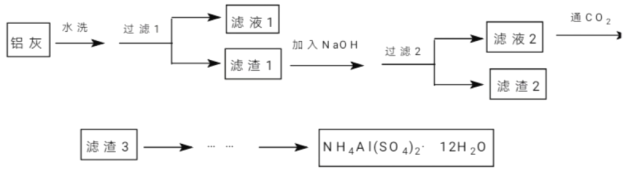
(1)下列有关说法中正确的是_________。
A.“滤液1”中含有K+、Mg2+、Cl-
B.“滤渣1”和“滤渣2”中含有相同的物质
C.“过滤1”可用倾析法,以缩减实验时间
D.将“滤液3”蒸干并灼烧,可得纯碱
(2)用NaOH溶解“滤渣1”时,可以采用_________的方式提高浸出率(写出3条)。
(3)向“滤液2”中通入足量的CO2,写出相应的离子反应方程式__________________。
(4)由“滤渣3”制备铵明矾,经过如下步骤:a→g→_________→h(依次填入正确的序号)
a.加硫酸溶解 b.抽滤
c.加入蒸发皿中
d.降温结晶
e.蒸发至表面出现晶膜
f.配制饱和硫酸铵溶液
g.将硫酸铝溶液转移至蒸发皿
h.洗涤、干燥
(5)①根据各物质的溶解度曲线(见下图),在80℃时,用一定浓度的硫酸溶解“滤渣3”时,最适宜的硫酸浓度为_________。

A.3mol/L(1.20g/mL)
B.6mol/L(1.34g/mL)
C.9mol/L(1.49 g/mL)
D.18mol/L (1.84g/mL)
②所需硫酸用量的简便确定方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com