
分析 (1)①氯气与水反应生成HCl与HClO;
②在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应,则:
Cl2(aq)+H2O(l)?HCl(aq)+HClO(aq)
起始浓度(mol/L):0.09 0 0
变化浓度(mol/L):0.03 0.03 0.03
平衡浓度(mol/L):0.06 0.03 0.03
再根据K=$\frac{c(HCl)×c(HClO)}{c(C{l}_{2})}$计算;
③在上述平衡体系中加入少量NaOH固体,氢氧化钠与HCl、HClO反应;
④如果增大氯气的压强,气体的溶解度增大,平衡向气体体积减小的方向移动;
(2)①已知:Ⅰ.3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g);△H=-246.4kJ•mol-1
Ⅱ.4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g),△H1=-205.1kJ•mol-1
根据盖斯定律,Ⅰ-Ⅱ可得:CO(g)+H2O(g)═CO2(g)+H2(g);△H2=△H-△H1;
②升高温度、增大压强、使用催化剂、增大物质浓度可以加快反应速率,同时提高CO转化率,应使平衡正向移动,但不能只增大CO浓度,否则CO转化率降低;
③a.反应后密度增大,说明体积减小,故反应向正反应进行建立平衡;
b.平衡时混合气体密度是同温同压下起始时的1.6倍,则平衡时混合气体物质的量为(3+3+1+1)mol×$\frac{1}{1.6}$=5mol,则:
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)物质的量减小△n=4
起始量(mol):3 3 1 1
变化量(mol):2.25 2.25 0.75 0.75 8mol-5mol=3mol
平衡量(mol):0.75 0.75 1.75 1.75
CO转化率=$\frac{物质的量变化量}{起始物质的量}$×100%.
解答 解:(1)①氯气与水反应生成HCl与HClO,反应离子方程式为:Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?H++Cl-+HClO;
②在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应,则:
Cl2(aq)+H2O(l)?HCl(aq)+HClO(aq)
起始浓度(mol/L):0.09 0 0
变化浓度(mol/L):0.03 0.03 0.03
平衡浓度(mol/L):0.06 0.03 0.03
该温度下平衡常数K=$\frac{c(HCl)×c(HClO)}{c(C{l}_{2})}$=$\frac{0.03×0.03}{0.06}$=0.15,
故答案为:0.15;
③在上述平衡体系中加入少量NaOH固体,氢氧化钠与HCl、HClO反应,故平衡向正反应方向移动,
故答案为:正反应方向;
④如果增大氯气的压强,气体的溶解度增大,平衡向气体体积减小的方向移动,即向正反应方向移动,
故答案为:增大;正反应方向;
(2)①已知:Ⅰ.3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g);△H=-246.4kJ•mol-1
Ⅱ.4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g),△H1=-205.1kJ•mol-1
根据盖斯定律,Ⅰ-Ⅱ可得:CO(g)+H2O(g)═CO2(g)+H2(g),则△H2=△H-△H1=-246.4kJ•mol-1
-(-205.1kJ•mol-1)=-41.3kJ•mol-1,
故答案为:-41.3kJ•mol-1;
②a.降低温度,平衡正向移动,CO转化率增大,但反应速率减慢,故a错误;
b.加入催化剂,反应速率加快,不影响平衡移动,CO转化率不变,故b错误;
c.缩小容器体积,压强增大,反应速率加快,平衡正向移动,CO转化率增大,故c正确;
d.增加H2的浓度,反应速率加快,平衡正向移动,CO转化率增大,故d正确;
e.增加CO的浓度,反应速率加快,平衡正向移动,但CO转化率减小,故e错误,
故选:cd;
③a.反应后密度增大,说明体积减小,故反应向正反应进行建立平衡,则反应开始时v(正)>v(逆),
故答案为:>;
b.平衡时混合气体密度是同温同压下起始时的1.6倍,则平衡时混合气体物质的量为(3+3+1+1)mol×$\frac{1}{1.6}$=5mol,则:
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)物质的量减小△n=4
起始量(mol):3 3 1 1
变化量(mol):2.25 2.25 0.75 0.75 8mol-5mol=3mol
平衡量(mol):0.75 0.75 1.75 1.75
平衡时n(CH3OCH3)=1.75mol,平衡时CO的转化率=$\frac{2.25mol}{3mol}$=75%×100%,
故答案为:1.75mol;75%.
点评 本题考查化学平衡计算与影响因素、平衡常数、反应速率影响因素、盖斯定律应用等,掌握三段式在化学平衡计算中应用.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题
 .
.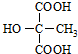 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | Fe跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | FeCl3与Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3跟硝酸反应:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始物质的量/mol | 0.1 | 0.3 | 0 |
| 平衡物质的量/mol | 0.05 | 0.2 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+2Y?2Z | |
| C. | 若起始时X、Y、Z的物质的量分别为0.1 mol、0.4mol、0.2mol,达平衡时,Z的体积分数一定增大 | |
| D. | 若起始时X、Y、Z的物质的量分别为0.05 mol、0.15mol、0.1mol,达平衡时,X的转化率一定与原投料相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g水中含有的水分子数是2NA | |
| B. | 标准状况下,33.6LCO中含有的原子数是3NA | |
| C. | 0.5L0.2mol/L的NaCl溶液中含有的Na+数是0.1NA | |
| D. | 常温常压下,1molCH4的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硫酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| D. | 某溶液中先滴加足量稀盐酸,无明显变化,再滴加少量BaCl2溶液,生成白色沉淀,证明该溶液一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com