
 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.
| ||
| ||


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| A、常温常压下,18g 18O2中含有NA个氧原子 |
| B、标准状况下,2.24 L水所含分子数为0.1NA个 |
| C、标准状况下,22.4 L空气含有NA个分子 |
| D、常温常压下,1.6克甲烷气体中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 、-CHO
、-CHO查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
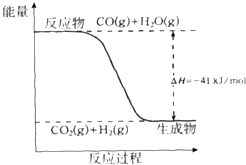 研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,平衡一定逆向移动 |
| B、若正反应是放热反应,则A为气态 |
| C、物质A一定为非气态,且正反应是吸热反应 |
| D、A可能为气态或非气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com