
【题目】下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数
B.对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数
C.升高温度,可以增大活化分子百分数
D.活化分子间的碰撞一定是有效碰撞
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 盐酸 | 醋酸 | 碳酸 | 氨水 | 氯水 |
B | 纯碱 | 碘酒 | 苛性钾 | 冰醋酸 | 干冰 |
C | 石油 | 石灰石 | 硫酸 | 磷酸 | 水 |
D | 烧碱 | 天然气 | 氯化钠 | 碳酸钠 | 蔗糖 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入500mL容量瓶中,恰好至刻度线,配成待测液备用.请改正以上操作中出现的五处错误.① , ② , ③ , ④ , ⑤ .
(2)将标准盐酸装在25.00mL滴定管中,调节液面位置在处,并记下刻度.
(3)取20.00mL待测液,待测定.该项实验操作的主要仪器有 . 用试剂作指示剂时,滴定到溶液颜色由刚好至色时为止.
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 .
(5)试分析滴定偏低误差可能由下列哪些实验操作引起的 .
A.转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读数(滴定管)开始时仰视,终点时俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,可逆反应:A(g)+B(g)xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是( ) 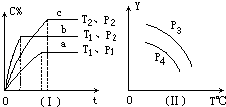
A.p3>p4 , Y轴表示A的质量
B.p3>p4 , Y轴表示混合气体平均摩尔质量
C.p3>p4 , Y轴表示混合气体密度
D.p3<p4 , Y轴表示B的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH为13的Ba(OH)2、NaOH的混合液100mL,从中取出24mL.用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.求:①当滴到沉淀不再增加时(溶液体积变化忽略不计),溶液的pH=________(已知:lg2=0.3).
②原混合溶液中c[Ba(OH)2]=________和c(NaOH)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类,例如:

(1)上图所示的物质分类方法名称是_____________。
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、④、⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②____ | ③NaOH ④___ | ⑤Na2SO4 ⑥____ | ⑦SO2 ⑧SO3 | ⑨NH3 |
(3)写出⑦转化为⑧的化学方程式_________________。
(4)写出单质Al与③溶液反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5依次发生的分解反应为:
①N2O5(g)N2O3(g)+O2(g)
②N2O3(g)N2O(g)+O2(g)
在容积为2L的密闭容器中充入8mol N2O5 , 加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
A.10.7
B.8.5
C.9.6
D.10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为____。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为____(已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为__________,K的原子结构示意图为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为__________________。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为____;
②该产气药剂中NaN3的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com