
��ˮ�к��зḻ��þ��Դ����ҵ�ϳ��ú�ˮɹ�κ�Ŀ�±ˮ��ȡMg����������ͼ��ʾ��
 ��1����ҵ��ȡþ�ķ������� �� ������
��1����ҵ��ȡþ�ķ������� �� ������
��2���Լ���һ��ѡ���� �� �����ѧʽ����
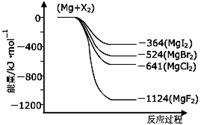
��3����ͼ�ǽ���þ��±�ط�Ӧ�������仯ͼ(��Ӧ��Ͳ����Ϊ298Kʱ���ȶ�״̬)��
����ͼ��֪Mg��±�ص��ʵķ�Ӧ��Ϊ �� ������ȡ������ȡ�����Ӧ���Ʋ⻯��������ȶ���˳��ΪMgI2 �� MgF2�����������������������
������ͼ����д��MgBr2(s)��Cl2(g)��Ӧ���Ȼ�ѧ����ʽ�� �� ����
��4������Mg��CH3Cl��һ�������·�Ӧ������CH3MgCl��CH3MgCl��һ����Ҫ���л��ϳ��Լ�������ˮ����ˮ�ⷴӦ������ɫ��ζ�������ɡ�д��CH3MgClˮ��Ļ�ѧ����ʽ�� �� ����
 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ϊ�ⶨNa2CO3��NaHCO3����������Na2CO3��������������ȡһ����������Ʒ����ͬѧ����ͼI��ʾװ�ò�������CO2���������ͬѧ����ͼII��ʾװ��ͨ������ܵ����ز�������CO2����������֪����ϡ�����������

��l��ʢ��ϡ�������������Ϊ ��
��2���Լ�XΪ ���Լ�YΪ ��
��3����ͬѧ�ڽ���ʵ��ʱ��Ϊ��С��Ӧע��������У���ѡ����ĸ�� ��
A������ǰӦʹ����װ����ȴ������
B������Z�ĸ߶�ʹ����װ������Һ����ƽ
C������ʱ������Z�ڰ�Һ����͵�����
D������ǰӦͨ��һ������N2ʹ���ɵ�CO2ȫ����������װ��
��4������ͬѧ��ʵ�鷽������ʵ�飬ʹ��õ�Na2CO3����������ƫ�ߵ������У�дһ�֣� ��
��5��Ϊ�����ͬ�IJⶨ��������ʵ�鷽�����ܴﵽʵ��Ŀ�ĵ��� ����ѡ����ĸ����
A��ȡmg�����������Ba��OH��2��Һ��ַ�Ӧ�����ˡ�ϴ�ӡ���ɵ�ng����
B��ȡmg����������������ַ�Ӧ������Һ���ȡ����ɡ����յ�ng����
C��ȡmg������ּ��ȣ�������������ng
D����ͼIIװ���е�ϡ�����Ϊϡ�������ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25 ��ʱ��ij����ͭ��Һ����������Ϊw�����ʵ���Ũ��Ϊc mol/L���ܶ�Ϊ�� g/mL��������Һ��ȥa gˮ������ԭ��Һ�м���b g��ˮ����ͭ��ĩ����־��ò��ָ���25 ��ʱ����ǡ��ȫ��ת��ΪCuSO4��5H2O���塣�����й�ϵʽ��ȷ��������
A��c=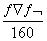 B��w=
B��w=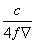
C��16a��9b  D��9a��16b
D��9a��16b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA���������ӵ�������ֵ������������ȷ���� ( )
A.��״���£�4.0 g CH4�к��й��ۼ�����ĿΪNA
B.���³�ѹ�£�6.4 g�����ͳ����к��еķ�������Ϊ0.2NA
C. 0.3 mol��L-1��NH4NO3��Һ�к��е�NO3����ĿΪ0.3NA
D.һ��������6.4g SO2������������Ӧ����SO3��ת�Ƶ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���� ( )
A���ϳɰ���Ӧ��ʹ�ô�����˵���������Դٽ���ƽ�������ɰ��ķ����ƶ�
B�������£�������ˮ����ϡ�ʹ��ᣬ��Һ��c(CH3COO��)/c(CH3COOH)��ֵ��С
C����ӦSiO2(s)+ 3C(s) = SiC(s) + 2CO(g)�����²����Է����У���÷�Ӧ�ġ�H��0
D������Ca(OH)2�ij����ܽ�ƽ�⣬�����¶ȣ�Ca(OH)2���ܽ���������Ksp��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ҹ����ֳ��л�����ռȫ��һ�룬���������PM2.5ϸ���Ӱ�����NH4��2SO4��NH4NO3,�л������P�ﳾ�ȡ�ͨ���ⶨ������п���ؽ����ĺ�������֪Ŀǰ����ҹ�����������Ҫ�ǽ�ͨ��Ⱦ��
(1) Zn2+�ڻ�̬ʱ��������Ų�ʽΪ�� �� ��
(2) SO42-�Ŀռ乹������ �� ��(����������)��
(3) PM2.5�����������ж����к����ʣ����������ι⻯ѧ������Ⱦ���⻯ѧ�����к���NOX��O3, CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)�ȶ�����Ⱦ�
������˵����ȷ������ �� ��(������ѡ��)��
a. N2O�ṹʽ�ɱ�ʾΪN=N=O
b. O3���ӳ�ֱ����
c.CH2=CH-CHO������̼ԭ�Ӿ�����sp2�ӻ�
d.��ͬѹǿ�£�HCOOH�е��CH30CH3�ߣ�˵��ǰ���Ǽ��Է��ӣ������ǷǼ��Է���
��1mo1PAN�к��Ҽ���ĿΪ�� �� ����
��NO�ܱ�FeSO4��Һ�������������[Fe(NO)(H2O)5]S04,��������������ӵ���λ��Ϊ
 �� ��(������).
�� ��(������).
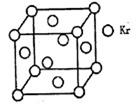
(4)�ⶨ������PM2.5��Ũ�ȷ���֮һ�Ǧ�һ�������շ�����һ���߷���Դ����85Kr����֪Kr����ľ����ṹ��ͼ��ʾ���辧������ÿ��Krԭ������ڵ�Krԭ����m���������к�Krԭ��Ϊn������m/n=�� �� ��(������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
W��X��Y��Z��Ϊ������Ԫ�أ�X��Y����ͬһ���ڣ�X��Z����ͼ����ӷֱ�ΪX2����Z����Y+��Z��������ͬ�ĵ��Ӳ�ṹ������˵����ȷ���ǣ�������
| �� | A�� | ԭ��������������X��Y��Z | B�� | ���ʷе㣺X��Y��Z |
| �� | C�� | ���Ӱ뾶��X2����Y+��Z�� | D�� | ԭ��������X��Y��Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����仯�����������������ϵ���У�
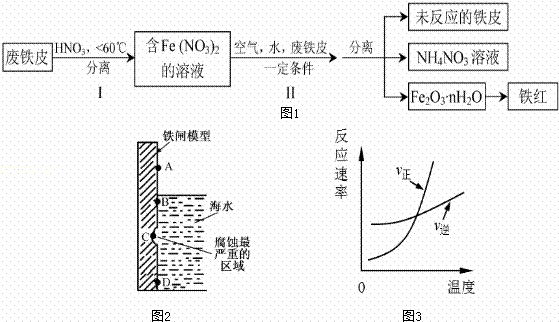
��1����ͼ2��ʵ�����о���ˮ����բ��ͬ��λ��ʴ���������ʾ��ͼ��һ��ʴ�����з�����ԭ��Ӧ���������������ѧʽ����ͼ2��A��B��C��D�ĸ�����������������������������ĸ����
��2���÷���Ƥ��ȡ���죨Fe2O3���IJ�������ʾ��ͼ���£���ͼ1��
���� I���¶ȹ��ߣ��������ڷ�Ӧ�Ľ��У����ʵ������ֺͻ�ѧ����ʽ���н��ͣ�������
������з�����Ӧ��4Fe��NO3��2+O2+��2n+4��H2O��2Fe2O3?nH2O+8HNO3����Ӧ������HNO3�ֽ�����Ƥ�е���ת��ΪFe��NO3��2���÷�Ӧ�Ļ�ѧ����ʽΪ���������������У������֡���ɫ��ѧ��˼�������������дһ���
��3����֪t��ʱ����ӦFeO��s��+CO��g��?Fe��s��+CO2��g����ƽ�ⳣ��ΪK1��д��K1�ı���ʽ���������÷�Ӧ�ں��������з�Ӧʱ����ͼ3��ʾ�仯����÷�Ӧ������ӦΪ������Ӧ��ѡ����ȡ����ȡ���������t���2L�����ܱ������м���0.02mol FeO��s������ͨ��һ����CO����5min��FeO��s��ת����Ϊ50%����CO2��ƽ����Ӧ����Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���淴Ӧ��2SO2(g)��O2(g)  2SO3(g)��һ�����������ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��(����)
2SO3(g)��һ�����������ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��(����)
�ٵ�λʱ��������n mol SO2��ͬʱ����n mol SO2
�ڵ�λʱ��������2n mol SO2��ͬʱ����n mol O2
����SO2��O2��SO3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��1��2��״̬
�ܻ��������ܶȲ��ٸı��״̬
A���٢� B���٢ڢ�
C���٢ڢ� D���٢ۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com